Tổng quan
Practice Essentials
Ung thư biểu mô vỏ thượng thận ( Adrenocortical carcinomas – ACs) là những khối u ác tính không phổ biến gây ra các biểu hiện lâm sàng không đặc trưng. Nhiều trường hợp khi được chẩn đoán thì đã di căn, vị trí di căn phổ biến là mô lân cận quanh tuyến thượng thận, hạch lympho, phổi, gan và cả xương. AC tương đối hiếm, cho dù vậy, nó chiếm 0.02-0.2% tổng số ca tử vong liên quan ung thư. Phát hiện khối u ở giai đoạn sớm rất quan trọng cho điều trị cắt bỏ.
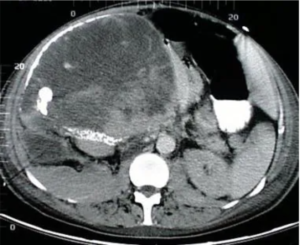
Bệnh nhân nữ 68 tuổi bị ung thư vỏ thượng thận nguyên phát lớn ở vùng bụng ¼ trên bên phải có vôi hóa. Vùng giảm tỷ trọng phía trước phù hợp với hoại tử.
Dấu hiệu và triệu chứng
Các triệu chứng giúp phát hiện bao gồm:
- Hội chứng nam hóa ở nữ
- Hội chứng Cushing
- Hội chứng nữ hoá ở nam (hiếm)
Bệnh nhân mắc chứng AC không hoạt động thường biểu hiện với bất kỳ triệu chứng nào sau đây:
- Sốt
- Sụt cân
- Đau và căng tức bụng
- Đau lưng
- Đầy bụng
- Các triệu chứng liên quan đến di căn
Chẩn đoán
Dựa vào cận lâm sàng
gồm có các xét nghiệm :
- Glucose huyết thanh
- Cortisol huyết thanh
- Androgen huyết thanh
- Hormone thượng thận trong nước tiểu
- Acid vanillylmandelic nước tiểu (VMA)
- Nồng độ acid homovanillic nước tiểu( HVA)
Chẩn đoán hình ảnh:
Chụp CT và MRI sẽ được lựa chọn trong AC. Trường hợp điển hình được đặc trưng bởi một bên tuyến thượng thận có kích thước lớn, bờ không đều. Kèm theo có hạch lân cận là bằng chứng xác thực.
Mô học
Một số đặc điểm nhìn thấy được của AC gợi ý bệnh ác tính bao gồm trọng lượng hơn 500 g, xuất hiện vùng vôi hóa hoặc hoại tử, các thuỳ kích thước lớn. Các phát hiện mô học cũng bao gồm: sự gia tăng nguyên phân, giảm tế bào chất, và không quan sát thấy có dạng hoa hồng nào ở trong u nguyên bào thần kinh.
Cách tiếp cận
Khi điều kiện khả thi, cắt bỏ toàn bộ khối u vẫn là phương thức tiếp cận được lựa chọn để điều trị dứt điểm AC. Nó cũng là cách chữa bệnh duy nhất. Trong khi phẫu thuật mở ổ bụng để cắt bỏ tuyến thượng thận – đại diện cho tiêu chuẩn chăm sóc, một số báo cáo cho thấy vai trò của phẫu thuật nội soi nếu khối u tuyến thượng thận nhỏ và chưa di căn.
Có thể sử dụng các phương pháp hỗ trợ sau, bao gồm :
- Điều trị hội chứng dư thừa nội tiết.
- Sử dụng mitotane hoặc một số phác đồ hóa trị liệu đa tác dụng
- Điều trị hoặc phòng tránh các biến chứng có khả năng xảy ra.
- Các chiến lược cho các vấn đề giảm nhẹ và chăm sóc giai đoạn cuối, bao gồm giảm nhẹ triệu chứng và hỗ trợ
Lý lịch
Ung thư biểu mô vỏ thượng thận ( Adrenocortical carcinomas – ACs) là những khối u ác tính không phổ biến gây ra các biểu hiện lâm sàng không điển hình. Nhiều trường hợp khi được chẩn đoán thì đã di căn, vị trí di căn phổ biến là mô lân cận quanh tuyến thượng thận, hạch lympho, phổi, gan và cả xương. AC thường phát triển ở 1 bên, mặc dù có báo cáo cho thấy ở chẩn đoán sơ bộ có 2-10% trường hợp phát triển ở cả 2 tuyến thượng thận; tuy nhiên, phát hiện này đã không được phổ biến.
Tăng sinh vỏ thượng thận là điển hình; nghiên cứu khám nghiệm tử thi cho thấy rằng khoảng 5-15% dân số trưởng thành nói chung có thể bị u tuyến thượng thận. Các khối thượng thận thường không cho chúng ta thấy biểu hiện về mặt sinh hóa và lâm sàng mà chỉ được phát hiện tình cờ trong quá trình khám sức khoẻ, chẳng hạn như chụp cắt lớp vi tính ổ bụng (CT) hoặc chụp cộng hưởng từ (MRI). Các phát hiện từ chụp CT bụng cho thấy tỷ lệ hiện mắc thấp hơn, chỉ 1-5%. Các khối u vỏ thượng thận lạc chỗ cực kỳ hiếm.
Chỉ một số nhỏ u tuyến thượng thận là có chức năng, và một số lượng nhỏ hơn nữa (khoảng 1/1500 case) là ác tính. Do đó, việc đánh giá các khối u tuyến thượng thận tập trung vào (1) xác định những khối ( mass) còn chức năng và điều trị chúng một cách thích hợp (bao gồm cả phẫu thuật cắt bỏ); (2) xác định sớm ung thư tuyến thượng thận, với mục đích cố gắng cắt bỏ hoàn toàn bằng phẫu thuật và (3) trấn an những bệnh nhân không có khối u chức năng hay ác tính và sắp xếp tái khám.
Phân loại u ác tính tuyến thượng thận
Ung thư vỏ thượng thận
Bao gồm:
- Có chức năng
- Không có chức năng
- Biệt hóa tốt
- Trung gian
- Biệt hóa kém đến không biệt hóa
U thượng thận di căn
Những vị trí có khả năng bị di căn nhất bao gồm:
- Phổi
- Vú
- Ung thư tế bào hắc tố (da)
- Ung thư biểu mô tế bào thận
- U lympho ngoài thuyến thượng thận
- Leukemia
- Ung thư biểu mô tụy
- Ung thư biểu mô ruột già
- Ung thư biểu mô buồng trứng
U tủy thượng thận
Bao gồm các loại sau :
- U tế bào ưa crom ác tính
- U hạch nguyên bào thần kinh
- U nguyên bào thần kinh
- Ung thư biểu mô nội tiết thần kinh
U ác tính mô đệm
Bao gồm:
- Neurofibrosarcoma (u sợi thần kinh)
- Angiosarcoma (u mạch máu ác tính)
- Liposarcoma (u mỡ)
- Fibrosarcoma (u của những mô liên kết dạng sợi)
- Leiomyosarcoma (u cơ xơ)
- Myxosarcoma (u niêm)
- Malignant tetaoma (u quái ác tính)
Các khối u ác tính tuyến thượng thận liên quan với các hội chứng có tính chất gia đình
Các hội chứng liên quan:
- Hội chứng Li-Fraumeni
- Bệnh đa polyp tuyến gia đình (Familial polyposis coli)
- Hội chứng Gardner
- Hội chứng Turcot
- Hội chứng Cowden
- Hội chứng Beckwith-Wiedemann (có thể)
- Tổ hợp Carney
- Tam chứng Carney
- Đa u tuyến nội tiết típ 1 (Multiple endocrine neoplasia type 1)
Khác
Chúng bao gồm u lympho tuyến thượng thận nguyên phát, có thể 1 bên hoặc 2 bên. Khối u ác tính tuyến thượng thận cũng có thể được phân loại thành u kết hợp và u hỗn hợp.
Khối u chức năng và không chức năng
Các khối u tuyến thượng thận được phân loại theo một số cách. Một phương pháp phổ biến có liên quan lâm sàng là phân loại thành chức năng và không chức năng, tùy thuộc vào tiết của hormone vỏ thượng thận (glucocorticoids, mineralocorticoids, androgens, estrogens; hiếm khi là một số peptide).
Các biến thể không chức năng của AC trước đây đã được báo cáo là ít phổ biến hơn nhiều so với các loại chức năng; các báo cáo cũ hơn cho rằng khoảng 50-80% AC là chức năng (bệnh nhân biểu hiện chủ yếu với hội chứng Cushing). Tuy nhiên, các báo cáo sau đó đã gợi ý rằng các AC không hoạt động có thể phổ biến hơn những gì trước đây họ nghĩ.
Các khối u đơn lẻ và u hội chứng
Một phương pháp phân loại khác là chia nhỏ ACs thành các biến thể đơn lẻ và hội chứng. Các biến thể hội chứng xảy ra với nhiều hội chứng có khuynh hướng ung thư, bao gồm hội chứng Gardner, hội chứng Beckwith-Wiedemann (liên quan đến chứng loạn sản), đa u nội tiết loại 1, hội chứng SBLA (sarcoma, ung thư biểu mô vú, phổi và tuyến thượng thận và các khối u khác liên quan đến một vài thế hệ trong gia đình, mà không có vị trí xác định trên 1 gen), và hội chứng Li-Fraumeni.
Nguồn gốc tế bào
Các khối u tuyến thượng thận có thể được phân loại dựa trên nguồn gốc tế bào. Bao gồm ACs nguyên phát, u lympho tuyến thượng thận nguyên phát, sarcom mô mềm của tuyến thượng thận, u tế bào ưa crom ác tính, u thượng thận di căn thứ phát (các khối u nguyên phát phổ biến là khối u vú, thận, phổi và buồng trứng, cũng như ung thư tế bào hắc tố (melanoma), leukemia và u lympho (lymphoma). Chỉ có các Acs là thường mới được đưa vào các cuộc thảo luận về ung thư tuyến thượng thận, và kiến thức này sẽ được giới hạn trong các cuộc thảo luận đó.
Các nhà chức trách cũng báo cáo các khối u thượng thận hỗn hợp hiếm gặp, là các biến thể mô học khác nhau có cùng nguồn gốc phôi thai (ví dụ, u nguyên bào thần kinh và u tế bào ưa crom ác tính ), và các khối u thượng thận hỗn hợp (điển hình là hỗn hợp của u tế bào ưa crom, sarcom tế bào hình thoi và ung thư biểu mô vỏ thượng thận).
Sinh lý bệnh
Các hội chứng nội tiết liên quan đến AC bao gồm:
- Hội chứng Cushing (30%)
- Nam hóa và dậy thì sớm (22%)
- Nữ hóa (10%)
- Cường aldosterol nguyên phát (2.5%)
- Dư thừa hormone kết hợp (Combined hormone excess) (35%)
- Đa hồng cầu (polycythemia) (<1%)
- Tăng calci huyết (<1%)
- Hạ đường huyết (<1%)
- Suy thượng thận ( đặc biệt do u lympho tuyến thượng thận nguyên phát)
- Kháng insulin không qua trung gian glucocorticoid
- Thừa catecholamine do một số trường hợp hiếm gặp của u tế bào ưa crom cùng tồn tại
- Cachexia (một hội chứng suy giảm sức khỏe gây rối loạn chuyển hóa)
Bệnh sinh
Nguyên nhân bệnh sinh chính xác của AC đơn lẻ không rõ ràng, nhưng phân tích các biến thể hội chứng của tình trạng này cung cấp một số thông tin hữu ích. Vai trò của đột biến gen ức chế khối u này có liên quan với hội chứng Li-Fraumeni,đặc trưng bởi sự bất hoạt đột biến dòng mầm của gen TP53 (một gen ức chế khối u quan trọng, hoặc gen kháng gen) trên nhiễm sắc thể 17. Hội chứng này cũng liên quan đến khuynh hướng của các khối u ác tính khác, bao gồm ung thư biểu mô vú, bệnh bạch cầu, u xương và sarcoma mô mềm.
Một số báo cáo mô tả mối liên quan giữa AC và đa polyp tuyến gia đình, cũng là do đột biến gây bất hoạt dòng mầm của gen ức chế khối u (trong trường hợp này là gen ức chế khối u đa chức năng APC). Tuy nhiên, những đột biến như vậy không được tìm thấy trong các trường hợp APC đơn lẻ
Tăng sản
Các gợi ý cho thấy các bệnh nhân tăng sản tuyến thượng thận có khuynh hướng phát triển thành AC. Một số trường hợp tăng sản thượng thận bẩm sinh liên quan với u tuyến vỏ thượng thận chức năng (adrenocortical adenomas) mà không phải là ung thư biểu mô ( carcinoma) Một số trường hợp AC có liên quan cường aldosterol nguyên phát (tuyến thượng thận có các phẩn vỏ tăng sản). Tuy nhiên, còn thiếu bằng chứng xác thực về trình tự tăng sản dẫn đến u tuyến, sau đó dẫn đến ung thư biểu mô – tương tự như trình tự tạo ra khối u đại tràng.
Tam chứng Carney
Mối liên quan giữa AC và tam chứng Carney (U mô đệm đường tiêu hóa Gastrointestinal stromal tumor- GIST, u sụn phổi pulmonary chondromas , u tế bào cận hạch thần kinh ngoài thượng thận extra-adrenal paraganglioma) còn ít được xác định. Có rất ít trường hợp được báo cáo vì tam chứng Carney gặp rất ít.
Cơ chế di truyền
Các cơ chế thuận lợi cho sự hình thành khối u vỏ thượng thận bao gồm :
- Kích hoạt các proto-oncogene khác nhau: Ras, PKC, C myc, C fos, G protein, và thụ thể bắt cặp G protein (ví dụ, vasoactive intestinal peptide [VIP], gastric-inhibitory peptide [GIP], luteinizing hormone [LH], catecholamines)
- Bất hoạt các gen ức chế khối u (antioncogenes): TP53, TP57, TP16, H19, gen u nguyên bào võng mạc, gen APC và các gen enzym sửa chữa DNA khác nhau
- Ức chế sự suy mòn ( già hoá và / hoặc apoptosis: Đột biến liên quan đến gen telomerase và / hoặc BCL-2
- Thay đổi các yếu tố đặc hiệu của mô vỏ thượng thận: Các đột biến liên quan đến các gen StaR, SF-1 (yếu tố tạo steroid) và yếu tố phiên mã Dax-1
- Các bất thường của receptor khi gắn lên : Hormon hướng vỏ thượng thận ( ACTH) angiotensin 2, catecholamine và endorphin
- Ngoài sự bất thường receptor còn có các tác nhân không điển hình khác như : Cytokine, yếu tố tăng trưởng và chất dẫn truyền thần kinh
Trong số các giả định về cơ chế bệnh sinh cho rằng có thể chức năng kết hợp giữa các tế bào với nhau bị thay đổi, cận tiết và tự tiết là hai yếu tố tác động đến các yếu tố tăng trưởng khác nhau, các cytokine được tạo bởi các tế bào khối u và sự hoạt động quá mức của các thụ thể ligand khác nhau trên màng tế bào (khiến các tế bào ở trong trạng thái quá kích thích vĩnh viễn). Điều này được cho là dẫn đến tăng sản tế bào tuyến thượng thận đơn độc, tăng sinh tự phát, hình thành khối u và tạo ra hormone.
Một số nghiên cứu phân tử về các tế bào khối u vỏ thượng thận cho thấy đột biến tại chỗ của gen TP53 và TP57 (cả hai gen antioncogenes) và tăng sản xuất yếu tố tăng trưởng giống insulin 2 (IGF-2). Đột biến gen TP53 là loại gen đột biến phổ biến nhất trong bệnh ung thư ở người. Một vai trò to lớn của gen này trong AC đơn lẻ được gợi ý bởi việc phát hiện thường xuyên mất tính dị hợp tử tại locus 17p13. Các đột biến tế bào mầm xác định của gen TP53 cũng đã được chứng minh ở hơn 90% trẻ em mắc bệnh AC ở miền nam Brazil, nơi có tỷ lệ mắc bệnh AC đơn lẻ cao nhất trên thế giới. biểu hiện rầm rộ của yếu tố steroid-1 (steroidogenic factor-1) cũng đã được mô tả trong lứa tuổi này.
Một locus di truyền khác cần biết là vị trí nhiễm sắc thể 11p cũng có thể chứa gen ức chế khối u và có liên quan đến các nghiên cứu liên kết ở những đối tượng mắc hội chứng Beckwith-Wiedemann. Mất dị hợp tử ở band 11p15 và biểu hiện quá mức của IGF-2, là gen nối tiếp ở vị trí di truyền này, đã được mô tả trong các trường hợp AC đơn lẻ.
Các nghiên cứu khác chứng minh rằng một số tế bào AC biểu hiện menin (sản phẩm gen gây dị ứng ở bệnh nhân đa u nội tiết loại I [MEN1]); trong các trường hợp khác, gen lai có liên quan đến bệnh aldosteron đáp ứng với glucocorticoid (GRA).
Một số báo cáo cho thấy rằng, trong khi các khối u tuyến thượng thận lành tính vẫn giữ biểu hiện của các kháng nguyên MHC loại 2, như chúng lại bị mất trong các tế bào ung thư biểu mô vỏ thượng thận. Hơn nữa, trong khi u tuyến thượng thận có thể là đơn dòng (43%), đa dòng (28%) hoặc hỗn hợp (28%), hầu như tất cả các AC đều là đơn dòng.
Thực tế là vỏ thượng thận bình thường có nhiều vị trí có các tế bào của tủy thượng thận nằm trong đó và tế bào vỏ thượng thận cũng nằm rải rác ở trong tủy thượng thận điều đó cho thấy có sự tương tác chặt chẽ giữa hai nhóm tế bào, mặc dù nguồn gốc phát sinh loài và phôi khác biệt của chúng. Sự liên quan của các tương tác chặt chẽ của các tế bào này trong quá trình hình thành bệnh nguyên của AC và khối u thượng thận nói chung vẫn đang được nghiên cứu tích cực.
Dịch tễ học
Các khối u AC không phổ biến, có tỷ lệ mắc khoảng 0,6-1,67 trường hợp trên một triệu người mỗi năm. Tuy nhiên, ở miền nam Brazil, tỷ lệ mắc các khối u tuyến thượng thận cao gấp 10-15 lần dân số chung, sự khác biệt có liên quan đến đột biến gen P53.
Nhân khẩu học liên quan đến giới tính và tuổi tác
Tỷ lệ nữ : nam đối với ACs là khoảng 2,5-3: 1. Việc thu thập số liệu đã cho thấy tỷ lệ mắc các khối u tuyến thượng thận ở nữ cao hơn , đặc biệt là ở những người từ 0-3 tuổi và những người trên 13 tuổi. AC không chức năng có tỷ lệ đều giữa hai giới.
AC xuất hiện ở cao ở 2 mốc thời gian: trong 10 năm đầu (<=10 tuổi) và 40-50 tuổi. Các khối u chức năng phổ biến hơn ở trẻ em, các khối u không chức năng lại phổ biến hơn ở người lớn.
Dựa trên cơ sở dữ liệu quốc tế về số lượng bệnh nhi mắc u thượng thận, lứa tuổi trẻ em có khả năng cao mắc ung thư thượng thận là 3,2 tuổi; 60% dưới 4 tuổi và 14% trên 13 tuổi.
Tiên lượng
AC tương đối hiếm gặp , chỉ chiếm 0,02-0,2% tổng số ca tử vong liên quan đến ung thư. Các chỉ số lâm sàng quan trọng nhất của tiên lượng gồm:
- Giai đoạn của bệnh lúc chẩn đoán
- Khả năng thành công của phẫu thuật cắt bỏ
- Có hoặc không có di căn tại thời điểm chẩn đoán
Dữ liệu theo dõi số lượng từ các trung tâm lớn , chẳng hạn như Trung tâm Ung thư MD Anderson và Trung tâm Ung thư Memorial Sloan-Kettering, cho thấy sự cải thiện tạm thời về tỷ lệ sống sót trên lâm sàng của bệnh nhân AC kể từ cuối những năm 1980 và đầu những năm 1990.
Bệnh nhân nam cao tuổi và có tiên lượng chung xấu hơn so với bệnh nhân nữ. Bệnh nhân nữ có nhiều khả năng mắc hội chứng liên quan đến nội tiết hơn bệnh nhân nam. Mặc dù vẫn còn một số tranh cãi, một số ý kiến cho rằng trẻ em mắc chứng AC có tiên lượng tốt hơn so với người lớn; Kết quả lâm sàng với tính khả thi này đã được báo cáo ở 70% hoặc hơn số ca bệnh nhi.
Việc phát hiện các khối u ở giai đoạn sớm là rất quan trọng đối với việc phẫu thuật cắt bỏ; cắt bỏ toàn bộ mang lại hi vọng chữa khỏi duy nhất. Tỷ lệ sống sót sau 5 năm ước tính của bệnh nhân AC là khoảng 20-35%. Đối với những trường hợp phẫu thuật cắt bỏ hoàn toàn, tỷ lệ này được ước tính là khoảng 32-47%, trong khi những trường hợp không thể cắt bỏ toàn bộ phẫu thuật, tỷ lệ sống sót sau năm năm được ước tính là 10-30%.
Tuy nhiên, ngay cả sau khi phẫu thuật cắt bỏ hoàn toàn, tái phát tại chỗ hoặc di căn xa vẫn xảy ra trong gần 80% trường hợp. Đã ghi nhận các trường hợp AC tái phát sau hơn 10 năm phẫu thuật điều trị , kết quả như vậy được cho là cuộc phẫu thuật thành công.. AC tái phát thường là dấu hiệu không khả thi. Mặc dù các triệu chứng của dư thừa nội tiết thường có thể được quản lý chặt chẽ, nhưng việc chữa khỏi gần như là chưa thể.
Sự hiện diện của di căn sẽ có tiên lượng xấu. Các ước tính cho thấy có tới 50% số bệnh nhân mắc bệnh qua đời trong vòng 12 tháng kể từ khi phát hiện khối u di căn, bất kể điều trị bằng cách nào. Thật vậy, những bệnh nhân mắc loại u vỏ thượng thận chức năng có thể có tiên lượng tốt hơn vì chúng xuất hiện sớm hơn, không giống như những bệnh nhân mắc u vỏ thượng thận không chức năng, luôn xuất hiện khi khối u rất lớn hoặc đã di căn xa.
Receptor estogen (ER) âm tính cũng gợi ý tiên lượng xấu hơn ở bệnh AC. Trong một nghiên cứu trên 17 bệnh nhân, Shen và cộng sự phát hiện ra rằng tỷ lệ sống sót sau một năm và năm năm lần lượt là 86% và 60% đối với bệnh nhân có khối u với ER dương tính, so với 38% và 0% đối với những bệnh nhân có khối u với ER âm tính
Tiên lượng cho các trường hợp AC xảy ra trong thai kỳ cũng rất khó khăn; tuy nhiên, tiên lượng thai nhi trong những trường hợp này vẫn rất tốt.
Những bệnh nhân không đáp ứng với mitotane hoặc tái phát có lẽ được chăm sóc đặc biệt hơn bằng cách đưa đến một trung tâm ung thư lớn, nơi họ có thể được đăng ký điều trị một trong số phác đồ kết hợp hóa trị liệu / xạ trị và / hoặc phẫu thuật cắt bỏ. AC không quá phổ biến đối với hầu hết các bệnh viện hạng 2 hoặc hạng 3 vì phải cần có đủ chuyên môn để quản lý những bệnh nhân này một cách đầy đủ.
Năm 2016, Kim và các đồng nghiệp đã công bố hình ảnh chụp nomogram để dự đoán khả năng sống sót không bị tái phát (RFS) và khả năng sống sót toàn thể (OS) sau khi phẫu thuật cắt bỏ ung thư biểu mô vỏ thượng thận (ACC). Các hình ảnh chụp nomogram được tạo ra bằng cách sử dụng một nhóm thuần tập đa cơ sở gồm 148 bệnh nhân đã trải qua phẫu thuật có mục đích điều trị cho ACC tại 13 cơ sở lớn của Hoa Kỳ.
Mô hình dự đoán cho RFS dựa trên 5 yếu tố tiên lượng độc lập sau:
- Kích thước khối u (<12 hoặc >=12cm)
- Tình trạng di căn hạch (N0, N1 hay Nx)
- Giai đoạn T (I/II hay III/IV)
- Khối u tiết cortisol
- Xâm lấn vào các khoang nhỏ
Nomogram để dự đoán OS dựa trên 3 yếu tố tiên lượng độc lập sau:
- Kích thước khối u (<12 hoặc >=12cm)
- Tình trạng di căn hạch (N0, N1 hay Nx)
- Vùng cắt bỏ-Resection margin
Dựa trên tổng số điểm có được, điểm càng cao thì có tiên lượng xấu hơn.
Biến chứng
Biến chứng AC có thể bao gồm:
- Sự xâm lấn khu trú của khối u: Bao gồm khả năng hình thành huyết khối khối u, có thể gây tắc mạch tương tự như ung thư biểu mô tế bào thận.
- Hội chứng dư thừa hormone (hội chứng Cushing, cường aldosterol, nam hóa, tăng huyết áp, rậm lông)
- Hội chứng cận ung thư (Paraneoplastic syndromes)
- Đau cục bộ ở bệnh nhân với di căn xương
Trong khi AC chỉ chiếm khoảng 5-10% các ca bệnh có hội chứng Cushing, thì ước tính khoảng 40% bệnh nhân vừa có hội chứng Cushing và kèm theo mass ở vùng thượng thận cũng sẽ được nghĩ đến đây là khối u ác tính. Hầu như tất cả các bệnh nhân nữ hóa ở nam giới có khối u tuyến thượng thận là ác tính.
Tài liệu tham khảo:
- Michalkiewicz E, Sandrini R, Figueiredo B, Miranda EC, Caran E, Oliveira-Filho AG, et al. Clinical and outcome characteristics of children with adrenocortical tumors: a report from the International Pediatric Adrenocortical Tumor Registry. J Clin Oncol. 2004 Mar 1. 22(5):838-45. [Medline].
- Dehner LP, Hill DA. Adrenal cortical neoplasms in children: why so many carcinomas and yet so many survivors?. Pediatr Dev Pathol. 2009 Jul-Aug. 12(4):284-91. [Medline].
- Tritos NA, Cushing GW, Heatley G, Libertino JA. Clinical features and prognostic factors associated with adrenocortical carcinoma: Lahey Clinic Medical Center experience. Am Surg. 2000 Jan. 66(1):73-9. [Medline].
- Shen XC, Gu CX, Qiu YQ, Du CJ, Fu YB, Wu JJ. Estrogen receptor expression in adrenocortical carcinoma. J Zhejiang Univ Sci B. 2009 Jan. 10(1):1-6. [Medline]. [Full Text].
- Kim Y, Margonis GA, Prescott JD, et al. Nomograms to Predict Recurrence-Free and Overall Survival After Curative Resection of Adrenocortical Carcinoma. JAMA Surg. 2016 Apr. 151 (4):365-73. [Medline]. [Full Text].
- Chen QL, Su Z, Li YH, Ma HM, Chen HS, Du ML. Clinical characteristics of adrenocortical tumors in children. J Pediatr Endocrinol Metab. 2011. 24(7-8):535-41. [Medline].
- Shah NS, Lila A. Childhood Cushing disease: a challenge in diagnosis and management. Horm Res Paediatr. 2011. 76 Suppl 1:65-70. [Medline].
- Angeli A, Osella G, Alì A, Terzolo M. Adrenal incidentaloma: an overview of clinical and epidemiological data from the National Italian Study Group. Horm Res. 1997. 47(4-6):279-83. [Medline].
- Hamrahian AH, Ioachimescu AG, Remer EM, Motta-Ramirez G, Bogabathina H, Levin HS, et al. Clinical utility of noncontrast computed tomography attenuation value (hounsfield units) to differentiate adrenal adenomas/hyperplasias from nonadenomas: Cleveland Clinic experience. J Clin Endocrinol Metab. 2005 Feb. 90(2):871-7. [Medline].
- Williams AR, Hammer GD, Else T. Transcutaneous biopsy of adrenocortical carcinoma is rarely helpful in diagnosis, potentially harmful, but does not affect patient outcome. Eur J Endocrinol. 2014 Jun. 170(6):829-35. [Medline].
- Villelli NW, Jayanti MK, Zynger DL. Use and Usefulness of Adrenal Core Biopsies Without FNA or On-site Evaluation of Adequacy: A Study of 204 Cases for a 12-Year Period. Am J Clin Pathol. 2012 Jan. 137(1):124-31. [Medline].
- Lau SK, Weiss LM. The Weiss system for evaluating adrenocortical neoplasms: 25 years later. Hum Pathol. 2009 Jun. 40(6):757-68. [Medline].
- Soon PS, Gill AJ, Benn DE, Clarkson A, Robinson BG, McDonald KL, et al. Microarray gene expression and immunohistochemistry analyses of adrenocortical tumors identify IGF2 and Ki-67 as useful in differentiating carcinomas from adenomas. Endocr Relat Cancer. 2009 Jun. 16(2):573-83. [Medline].
- Duregon E, Molinaro L, Volante M, Ventura L, Righi L, Bolla S, et al. Comparative diagnostic and prognostic performances of the hematoxylin-eosin and phospho-histone H3 mitotic count and Ki-67 index in adrenocortical carcinoma. Mod Pathol. 2014 Jan 17. [Medline].
- International Union Against Cancer. TNM Classification of MalignantTumours – 7th edition. Available at http://blogs.globalink.org/uicc/templates/uicc/pdf/tnm/tnm_7th_edition_summary_091016.pdf. Accessed: December 1, 2009.
- Fassnacht M, Johanssen S, Quinkler M, Bucsky P, Willenberg HS, Beuschlein F, et al. Limited prognostic value of the 2004 International Union Against Cancer staging classification for adrenocortical carcinoma: proposal for a Revised TNM Classification. Cancer. 2009 Jan 15. 115(2):243-50. [Medline].
- Baudin E, Leboulleux S, Al Ghuzlan A, Chougnet C, Young J, Deandreis D, et al. Therapeutic management of advanced adrenocortical carcinoma: what do we know in 2011?. Horm Cancer. 2011 Dec. 2(6):363-71. [Medline].
- El Ghorayeb N, Rondeau G, Latour M, Cohade C, Olney H, Lacroix A, et al. Rapid and Complete Remission of Metastatic Adrenocortical Carcinoma Persisting 10 Years After Treatment With Mitotane Monotherapy: Case Report and Review of the Literature. Medicine (Baltimore). 2016 Mar. 95 (13):e3180. [Medline]. [Full Text].
- Terzolo M, Angeli A, Fassnacht M, Daffara F, Tauchmanova L, Conton PA, et al. Adjuvant mitotane treatment for adrenocortical carcinoma. N Engl J Med. 2007 Jun 7. 356(23):2372-80. [Medline].
- Yongquan Tang 1 , Zhihong Liu 1 , Zijun Zou 1 , Jiayu Liang 1 , Yiping Lu 1 , Yuchun Zhu. Benefits of Adjuvant Mitotane after Resection of Adrenocortical Carcinoma: A Systematic Review and Meta-Analysis. Biomed International Research. June 4 2018. [Medline]. [Full Text].
- [Guideline] Neuroendocrine and Adrenal Tumors. National Comprehensive Cancer Network. Available at https://www.nccn.org/professionals/physician_gls/pdf/neuroendocrine.pdf. Version 2.2020 — July 24, 2020; Accessed: September 14, 2020.
- Fassnacht M, Terzolo M, Allolio B, Baudin E, Haak H, Berruti A, et al. Combination chemotherapy in advanced adrenocortical carcinoma. N Engl J Med. 2012 Jun 7. 366(23):2189-97. [Medline].
- Habra MA, Stephen B, Campbell M, Hess K, Tapia C, Xu M, et al. Phase II clinical trial of pembrolizumab efficacy and safety in advanced adrenocortical carcinoma. J Immunother Cancer. 2019 Sep 18. 7 (1):253. [Medline].
- Raj N, Zheng Y, Kelly V, Katz SS, Chou J, Do RKG, et al. PD-1 Blockade in Advanced Adrenocortical Carcinoma. J Clin Oncol. 2020 Jan 1. 38 (1):71-80. [Medline].
- T. M. Kerkhofs, E. Baudin, M. Terzolo, B. Allolio, R. Chadarevian, H. H. Mueller, et al. Comparison of Two Mitotane Starting Dose Regimens in Patients With Advanced Adrenocortical Carcinoma. The Journal of Clinical Endocrinology & Metabolism. 1 December 2013. 98:4759-4767. [Full Text].
- Ronchi CL, Sbiera S, Kraus L, Wortmann S, Johanssen S, Adam P, et al. Expression of excision repair cross complementing group 1 and prognosis in adrenocortical carcinoma patients treated with platinum-based chemotherapy. Endocr Relat Cancer. 2009 Sep. 16(3):907-18. [Medline].
- Polat B, Fassnacht M, Pfreundner L, Guckenberger M, Bratengeier K, Johanssen S, et al. Radiotherapy in adrenocortical carcinoma. Cancer. 2009 Jul 1. 115(13):2816-23. [Medline].
- Kazaryan AM, Marangos IP, Rosseland AR, Røsok BI, Villanger O, Pinjo E, et al. Laparoscopic adrenalectomy: Norwegian single-center experience of 242 procedures. J Laparoendosc Adv Surg Tech A. 2009 Apr. 19(2):181-9. [Medline].
- Zografos GN, Vasiliadis G, Farfaras AN, Aggeli C, Digalakis M. Laparoscopic surgery for malignant adrenal tumors. JSLS. 2009 Apr-Jun. 13(2):196-202. [Medline].
- Kulis T, Knezevic N, Pekez M, Kastelan D, Grkovic M, Kastelan Z. Laparoscopic Adrenalectomy: Lessons Learned from 306 Cases. J Laparoendosc Adv Surg Tech A. 2011 Dec 13. [Medline].
- Agha A, Iesalnieks I, Hornung M, Phillip W, Schreyer A, Jung M, et al. Laparoscopic trans- and retroperitoneal adrenal surgery for large tumors. J Minim Access Surg. 2014 Apr. 10(2):57-61. [Medline]. [Full Text].
- Datrice NM, Langan RC, Ripley RT, Kemp CD, Steinberg SM, Wood BJ, et al. Operative management for recurrent and metastatic adrenocortical carcinoma. J Surg Oncol. 2011 Dec 20. [Medline].
- Hermsen IG, Gelderblom H, Kievit J, Romijn JA, Haak HR. Extremely long survival in six patients despite recurrent and metastatic adrenal carcinoma. Eur J Endocrinol. 2008 Jun. 158(6):911-9. [Medline].
- Kemp CD, Ripley RT, Mathur A, et al. Pulmonary resection for metastatic adrenocortical carcinoma: the National Cancer Institute experience. Ann Thorac Surg. 2011 Oct. 92(4):1195-200. [Medline].
- Schulick RD, Brennan MF. Long-term survival after complete resection and repeat resection in patients with adrenocortical carcinoma. Ann Surg Oncol. 1999 Dec. 6(8):719-26. [Medline].
- Hah JO. Intensive chemotherapy with autologous PBSCT for advanced adrenocortical carcinoma in a child. J Pediatr Hematol Oncol. 2008 Apr. 30(4):332-4. [Medline].
- [Guideline] Fassnacht M, Dekkers OM, Else T, Baudin E, Berruti A, de Krijger R, et al. European Society of Endocrinology Clinical Practice Guidelines on the management of adrenocortical carcinoma in adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2018 Oct 1. 179 (4):G1-G46. [Medline]. [Full Text].
- Grubbs EG, Callender GG, Xing Y, Perrier ND, Evans DB, Phan AT, et al. Recurrence of Adrenal Cortical Carcinoma Following Resection: Surgery Alone Can Achieve Results Equal to Surgery Plus Mitotane. Ann Surg Oncol. 2009 Oct 23. [Medline].
- Postlewait LM, Ethun CG, Tran TB, et al. Outcomes of Adjuvant Mitotane after Resection of Adrenocortical Carcinoma: A 13-Institution Study by the US Adrenocortical Carcinoma Group. J Am Coll Surg. 2016 Apr. 222 (4):480-90. [Medline]. [Full Text].
Link bài gốc: Adrenal Carcinoma
Người dịch: Lý Anh
Biên tập: Kim Luận
Bài viết được dịch thuật và biên tập bởi ykhoa.org – vui lòng không reup khi chưa được cho phép!
 Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.
Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.