1.THUỐC LỢI TIỂU VÀ CƠ CHẾ TÁC DỤNG
Thuốc lợi tiểu là thuốc có tác dụng làm tăng lượng nước tiểu thải ra, giống như tên của nó. Hầu hết các thuốc lợi tiểu cũng làm tăng đào thải các chất hòa tan trong nước tiểu, đặc biệt là natri và clo. Thực tế, các thuốc lợi tiểu gây ra tác dụng lâm sàng bằng việc giảm tái hấp thu Natri ở ống thận, từ đó dẫn đến tăng lượng Natri trong nước tiểu (tăng đào thải Na), kết quả là dẫn đến lợi tiểu (tăng đào thải nước). Trong hầu hết các trường hợp, tăng đào thải nước tiểu xảy ra sau quá trình ức chế tái hấp thu Natri ở ống thận bởi vì lượng Na còn lại trong ống thận sẽ làm tăng áp lực thẩm thấu và dẫn đến giảm tái hấp thu nước. Do ống thận tái hấp thu rất nhiều các chất điện giải, ví dụ như: kali, clo, magie và calci, và quá trình tái hấp thu các chất này cũng xảy ra thứ phát sau quá trình tái hấp thu Natri, nên nhiều thuốc lợi tiểu cũng đồng thời làm tăng đào thải các chất hòa tan.
Tác dụng lâm sàng chủ yếu của các thuốc lợi tiểu là làm giảm lượng dịch ngoại bào, đặc biệt trong những bệnh có kèm theo phù và tăng huyết áp. Như đã được thảo luận ở chương 25, mất Natri trong cơ thể sẽ chủ yếu dẫn tới giảm lượng dịch ngoại bào, do đó, các thuốc lợi tiểu thường được sử dụng trên lâm sàng trong những trường hợp tăng lượng dịch ngoại bào.
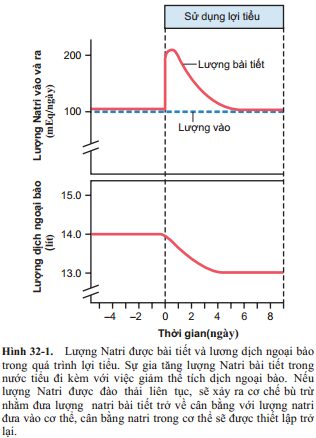
Một số thuốc lợi tiểu có thể làm tăng lượng nước tiểu lên gấp 20 lần chỉ trong vài phút sau khi sử dụng. Tuy nhiên, hiệu quả của phần lớn các thuốc lợi tiểu trong việc đào thải muối và nước sẽ giảm đi trong vòng vài ngày (Hình 32-1). Điều này là cơ chế bù trừ của cơ thể đã được hoạt hóa do giảm lượng dịch ngoại bào. Ví dụ, việc giảm lượng dịch ngoại bào có thể dẫn đến hạ huyết áp động mạch và giảm mức lọc cầu thận (GFR) từ đó làm tăng tiết renin và hình thành angiotensin II; tất cả các phản ứng này cuối cùng sẽ làm chống lại hiệu quả lâu dài của các thuốc lợi tiểu trong việc đào thải nước tiểu. Như vậy, trong trạng thái ổn định, sau khi có sự giảm huyết áp và giảm lượng dịch ngoại bào, lượng nước tiểubài tiết ra sẽ bằng lượng nước vào, vì vậy nói đến tác dụng làm hạ huyết áp hay giảm phù của thuốc lợi tiểu là nói đến giai đoạn đầu trong quá trình sử dụng thuốc.
Các thuốc lợi tiểu đang được sử dụng trên lâm sàng cócác cơ chế tác dụng khác nhau tùy thuộc vào vị trí ức chế tái hấp thu của chúng trên ống thận.
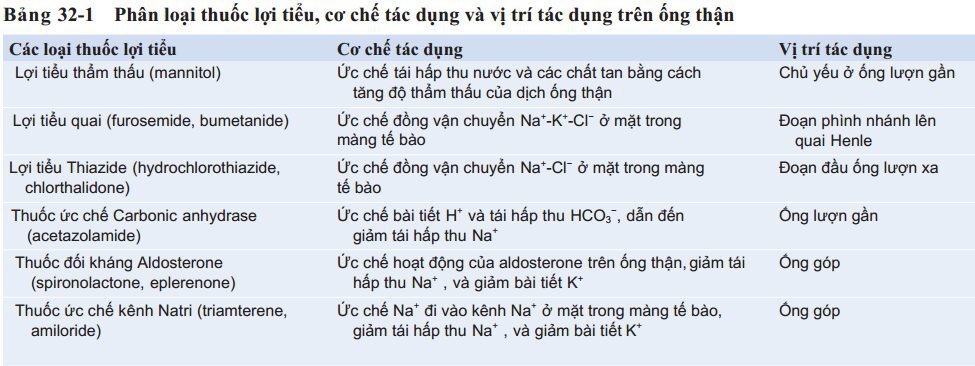
Phân loại thuốc lợi tiểu, cơ chế tác dụng và vị trí tác dụng của thuốc được trình bày trong Bảng 32-1.
LỢI TIỂU THẨM THẤU GIẢM TÁI HẤP THU NƯỚC BẰNG CÁCH TĂNG ÁP LỰC THẨM THẤU TRONG LÒNG ỐNG THẬN
Một số chất khi đưa vào trong máu không được tái hấp thu dễ dàng bởi ống thận, ví dụ như: ure, mannitol, sucrose, điều này làm tăng nồng độ các chất hòa tan có hoạt tính thẩm thấu ở trong lòng ống. Áp suất thẩm thấu trong lòng ống tăng sẽ làm giảm quá trình tái hấp thu và kéo theo một lượng lớn nước vào lòng ống để tạo nước tiểu.
Lượng lớn nước tiểu cũng được đào thải trong các bệnh liên quan đến sự dư thừa các chất hòa tan và không được tái hấp thu từ lòng ống. Ví dụ, trong bệnh đái tháo đường, lượng glucose được lọc vào trong ống thận vượt quá khả năng tái hấp thu glucose (vượt quá khả năng vận chuyển tối đa glucose). Khi nồng độ tập trung glucose lớn hơn 250 mg/dl, chỉ 1 lượng nhỏ glucose sẽ được tái hấp thu, lượng lớn glucose còn lại trong lòng ống thận sẽ đóng vai trò như một chất lợi tiểu thẩm thấu, và là nguyên nhân kéo dịch nhanh chóng vào nước tiểu. Vì vậy, một trong những đặc điểm quan trọng của bệnh đái tháo đường không kiểm soát là đa niệu (đi tiểu thường xuyên), điều nay được cân bằng bởi một lượng lớn dịch được đưa vào cơ thể (uống nhiều), bởi khi cơ thể mất nước sẽ làm tăng độ thẩm thấu của dịch ngoại bào, và kích hoạt cơ chế tiếp theo gây khát.
LỢI TIỂU QUAI: GIẢM TÁI HẤP THU NATRI-CLO-KALI Ở ĐOẠN PHÌNH TO NHÁNH LÊN QUAI HENLE
Furosemide, ethacrynic acid, và bumetanide là những chất lợi tiểu mạnh do ức chế tích cực sự tái hấp thu ở đoạn phình to nhánh lên quai Henle. Các chất nàyức chế cơ chế đồng vận chuyển 1Na-2Cl-1K ở mặt trong màng tế bào biểu mô.Thuốc lợi tiểu quai là một trong những thuốc lợi tiểu mạnh nhất hiện đang được sử dụng trên lâm sàng.
Bằng việc ức chế cơ chế đồng vận chuyển Natri-clo-kali ở mặt trong màng của quai Henle, thuốc lợi tiểu quai làm tăng đào thải ra nước tiểu: Natri, clo, kali, nước cũng như các chất điện giải khác, bởi 2 lí do: (1) chúng làm tăng đáng kể các chất hòa tan chuyển đến ống lượn xa, và các chất tan này đóng vai trò như các chất lợi tiểu thẩm thấu làm cản trở quá trình tái hấp thu nước; và (2) chúng phá vỡ cơ chế nhân nồng độ ngược dòng bằng việc giảm hấp thu các ion ở quai Henle vào vùng kẽ tủy, qua đó làm giảm áp lực thẩm thấu ở dịch kẽ tủy. Do tác động trên, lợi tiểu quai làm giảm khả năng của thận trong việc cô đặc hoặc làm loãng nước tiểu.
Khả năng làm loãng nước tiểu bị suy giảm do sự ức chế tái hấp thu natri và clo ở quai Henle dẫn đến bài tiết nhiều ion cùng với tăng bài tiết nước. Khả năng cô đặc nước tiểu bị suy giảm do giảm sự tập trung các ion vào vùng kẽ tủy thận, dẫn đến áp lựcthẩm thấu ở vùng tủy thận giảm. Kết quả là, giảm tái hấp thu dịch ở ống góp, khả năng tối đa của thận trong việc cô đặc nước tiểu giảm. Thêm vào đó, độ thẩm thấu ở vùng kẽ tủy của thận giảm làm giảm sự hấp thu nước ở nhánh xuống quai Henle. Do những tác động trên, 20-30% lượng dịch được lọc ở cầu thận sẽ được chuyển thêm vào nước tiểu để đào thải ra ngoài, trong những tình trạng cấp tính, lượng nước tiểu có thể tăng lên gấp 25 lần bình thường trong vòng vài phút.
LỢI TIỂU THIAZIDE ỨC CHẾ TÁI HẤP THU NATRI VÀ CLO Ở PHẦN ĐẦU ỐNG LƯỢN XA
Các dẫn xuất của thiazide, ví dụ như chlorothiazide, tác động chủ yếu lên phần đầu ống lượn xa qua việc ức chế vị trí đồng vận chuyển Na-Cl nằm ở mặt trong màng tế bào ống thận. Trong điều kiện thuận lợi, các thuốc này có thể bài tiết thêm tối đa khoảng 5-10% lượng dịch lọc cầu thận vào nước tiểu, tương đương với lượng natri bình thường được tái hấp thu ở ống lượn xa.
THUỐC ỨC CHẾ CARBONICANHYDRASE ỨC CHẾ TÁI HẤP THU NAHCO3 Ở ỐNG LƯỢN GẦN
Acetazolamide ức chế enzyme carbonic anhydrase, enzym đóng vai trò quan trọng trong quá trình tái hấp thu bicarbonat(HCO3-) ở ống lượn gần, như đã thảo luận ở chương 31.
Carbonic anhydrase córất nhiều ở ống lượn gần- vị trí tác dụng chính của các thuốc ức chếcarbonic anhydrase. Một số ít enzym Carbonic anhydrase cũng có trong các tế bào ống khác, ví dụ như trong các tế bào kẽ của ống góp.
Do việc bài tiết ion hydro (H+) và tái hấp thu HCO3– ở ống lượn gần được thực hiện cùng nhau thông qua cơ chế đồng vận chuyển ngược chiều Na-H+ ở mặt trong màng, giảm tái hấp thu HCO3- cũng làm giảm tái hấp thu natri. Việc ức chế tái hấp thu Natri và HCO3- dẫn đến các ion này tiếp tục ở trong lòng ống và trở thành một chất lợi tiểu thẩm thấu. Có thể đoán trước được, một nhược điểm của thuốc ức chế carbonic anhydrase là việc gây ra tình trạng nhiễm toan chuyển hóa do mất quá nhiều HCO3- vào nước tiểu.
ĐỐI KHÁNG THU THỂ MINERALOCORTICOID GIẢM TÁI HẤP THU NATRI VÀ GIẢM BÀI TIẾT KALI CỦA ỐNG GÓP
Spironolactone và eplerenone là các thuốc đối kháng thụ thể mineralocorticoid, cạnh tranh với aldosterone tại receptor của nótrên tếbào biểu mô ống góp và, vì vậy, làm giảm tái hấp thu Natri và giảm bài tiết kali ở đoạn này.
Kết quả của việc này là Natri vẫn còn bên trong ống và hoạt động như một thuốc lợi tiểu thẩm thấu, dẫn đến tăng bài tiết nước. Do các thuốc này cũng ức chế tác dụng của aldosterone trong việc làm tăng bài tiết kali, nên dẫn đến giảm bài tiết kali ra nước tiểu. Đối kháng thụ thể mineralocorticoid cũng làm kali từ các tế bào đi vào trong dịch ngoại bào. Trong một số trường hợp, sự chuyển dịch này làm tăng quá mức nồng độ kali trong dịch ngoại bào. Vì lí do này, spironolactone và các thuốc đối kháng thụ thể mineralocorticoid được gọi là lợi tiểu giữ kali. Rất nhiều thuốc lợi tiểu gây mất kali ra nước tiểu, đối lập với đó là các thuốc đối kháng thụ thể mineralocorticoid, giúp chống lại sự mất kali.
THUỐC CHẸN KÊNH NATRI – GIẢM TÁI HẤP THU NATRI Ở ỐNG GÓP
Amiloride và triamterene cũng ức chế tái hấp thu Natri và bài tiết Kali ở ống góp, tương tự như cơ chế củaspironolactone. Tuy nhiên, ở mức độ tế bào, các thuốc này tác động trực tiếp để ngăn chặn Natri đi vào các kênh Natri ở mặt trong màng tế bào biểu mô ống góp. Do điều này làm giảm Natri đi vào các tế bào biểu mô, nên nó cũng làm giảm vận chuyển natri qua màng ngoài của tế bào và do đó làm giảm hoạt động của bơm Natri-Kali-ATP.
Sự giảm hoạt động của bơm Natri-Kali-ATP làm giảm vận chuyển Kali vào trong tế bào và do đó làm giảm bài tiết Kali vào dịch trong lòng ống thận. Vì lí do này, thuốc chẹn kênh Natri còn được gọi là lợi tiểu giữ kali, và giảm tỷ lệ bài tiết kali ra nước tiểu.
2.BỆNH THẬN
Bệnh thận là một trong những nguyên nhân hàng đầu dẫn đến tử vong và tàn tật của nhiều quốc gia trên thế giới. Ví dụ, trong năm 2014, theo ước tính có hơn 10% người trưởng thành ở Mỹ, hay hơn 26 triệu người mắc bệnh thận mạn, và hàng triệu người có tổn thương thận cấp hoặc các hình thức ít nghiêm trọng hơn của rối loạn chức năng thận.
Bệnh thận nguy hiểm có thể được chia làm 2 loại chính:
1.Tổn thương thận cấp (AKI), là tình trạng mất độtngột chức năng thận trong vòng một vài ngày, thuật ngữ suy thận cấp thường được sử dụng trong các trường hợp tổn thương thận cấp tính, thận đột ngộtdừng hoạt động hoàn toàn hoặc gần hoàn toàn, cần thiết phải sử dụng các liệu pháp điều trị thay thế thận, ví dụ như lọc máu, sẽ được thảo luận sau trongchương này. Trongmột số trường hợp, bệnh nhân AKI sau điều trị có thể phục hồi chức năng thận gần như bình thường.
- Bệnh thận mạn (CKD), là tình trạng mất dần chức năng của các nephron, từ đó dẫn đến giảm
dần chức năng tổng thể của thận.
Trong phạm vi 2 phân loại trên, có rất nhiều các bệnh thận cụ thể có thể ảnh hưởng đến các mạch máu thận, cầu thận, ống thận, kẽ thận, các bộ phận của đường tiết niệu bên ngoài thận bao gồm cả niệu quản và bàng quang. Trong chương này, chúng tôi sẽ thảo luận về những biến đổi sinh lý cụ thể xảy ra trong một vài thể bệnh thận quan trọng.
TỔN THƯƠNG THẬN CẤP
Các nguyên nhân dẫn đến tổn thương thận cấp (AKI) có thể chia thành 3 nguyên nhân chính sau:
- AKI trước thận: Do giảm lượng máu tới thận. Tình trạng này thường được gọi là tổn thương thận cấp trước thận nhằm phản ánh nguyên nhân xuất phát từ các cơ quan bên ngoài thận. Ví dụ, AKI trước thận có thể là hậu quả của suy tim với việc giảm cung lượng tim và hạ huyết áp hoặc những tình trạng có liên quan đến việc giảm thể tích máu và hạ huyết áp, ví dụ như mất máu cấp.
- AKI tại thận: là hậu quả của những bất thường tại thận, bao gồm các mạch máu thận, cầu thận hoặc ống thận.
- AKI sau thận: là kết quả của sự tắc nghẽn hệ thống thu nhận nước tiểu ở bất cứ vị trí nào từ các đài thận cho tới bàng quang. Các nguyên nhân phổ biến nhất gây ra tắc nghẽn đường tiết niệu ngoài thận là sỏi thận, kết quả của việc lắng đọng canxi, urat hoặc cystine.
AKI TRƯỚC THẬN DO GIẢM LƯỢNG MÁU TỚI THẬN
Bình thường, thận nhận một lượng máu dồi dào với khoảng 1100ml mỗi phút, hay 20-25% cung lượng tim. Mục đích chính của việc cung cấp một lượng máu lớn tới thận là để cung cấp đủ huyết tương với lương dịch và nồng độ các chất tan cần thiết cho việc lọc ở cầu thận có hiệu quả. Vì vậy, giảm dòng máu đến thận thường đi kèm với việc giảm GFR và giảm lượng nước và các chất tan trong nước tiểu. Kết quả là, tình trạng giảm cấp tính dòng máu tới thận sẽ gây ra thiểu niệu, hay nói cách khác lượng nước tiểu đào thải giảm so với lượng nước và các chất tan đưa vào cơ thể. Tình trạng này sẽ dẫn đến giữ nước và các chất tan trong các dịch cơ thể. Nếu lượng máu tới thận giảm đáng kể, hoàn toàn không có nước tiểu đào thải ra bên ngoài, tình trạng đó được gọi là vô niệu.
Khi lượng máu tới thận chưa giảm xuống dưới 20-25% mức bình thường, tình trạng tổn thương thận cấp có thể được đảo ngược nếu điều trị được nguyên nhân gây ra thiếu máu cục bộ ở thận trước khi các tế bào thận bị tổn thương. Không giống như các mô khác, thận có thể chịu đựng sự giảm tương đối lớn lượng máu tới thận trước khi tổn thương thực thể ở các tế bào thận xảy ra. Lý giải cho hiện tượng này là khi dòng máu tới thận giảm, GFR và lượng NaCl được lọc bởi cầu thận (cũng như tỷ lệ lọc nước và các chất điện giải khác) giảm. Điều này làm giảm lượng NaCl đáng lẽ phải được hấp thu bởi ống thận, và trong đó sử dụng phần lớn năng lượng và oxy của thận bình thường. Vì vậy, khi lượng máu tới thận và GFR giảm, nhu cầu tiêu thụ oxi của thận cũng giảm. Khi GFR tiến về 0, nhu cầu oxy của thận tiến về mức đủ để duy trì sự sống cho các tế bào ống thận ngay cả khi không tái hấp thu Natri. Khi dòng máu tới thận giảm thấp hơn nhu cầu cơ bản này, thường dưới20-25% dòng máu tới thận bình thường, các tế bào thận trở nên thiếu oxy, và giảm hơn nữa lượng máu tới thận, nếu kéo dài, sẽ gây tổn thương hoặc thậm chí gây chết các tế bào thận, đặc biệt là các tế bào biểu mô ống thận.
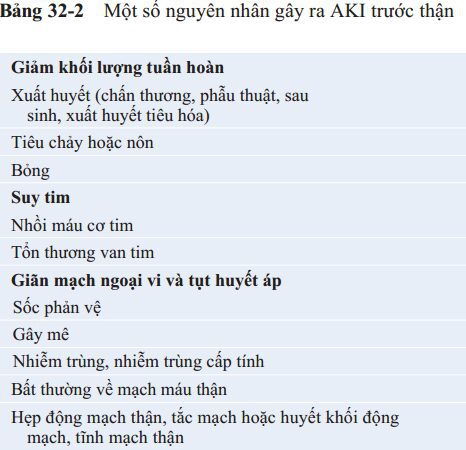
Nếu nguyên nhân gây ra AKI trước thận không được sửa chữa và tình trạng thiếu máu cục bộ tại thận tồn tại lâu hơn vài giờ, loại suy thận này có thể tiến triển thành AKI tại thận, sẽ được thảo luận sau. Giảm cấp tính lượng máu tới thận là nguyên nhân thường gặp nhất gây ra AKI ở những bệnh nhân nhập viện, đặc biệt là ở những bệnh nhân có chấn thương thận nghiêm trọng. Bảng 32-2 liệt kê một số nguyên nhân gây giảm lượng máu tới thận và gây ra AKI trước thận.
TỔN THƯƠNG THẬN CẤP TẠI THẬN DO CÁC BẤT THƯỜNG Ở THẬN
Những bất thường có nguồn gốc từ bên trong thận và làm giảm đột ngột lượng nước tiểu được xếp vào nhóm AKI tại thận. AKI tại thận có thể chia thành các nhóm sau: (1) tình trạng tổn thương các mao mạch cầu thận hoặc các mạch nhỏ của thận, (2) tình trạng tổn thương biểu mô ống thận, và (3) tình trạng gây tổn thương kẽ thận. Các nhóm trên đươc phân loại dựa trên vị trí tổn thương ở thận, nhưng do các mạch máu thận và hệ thống các ống thận có mối quan hệ phụ thuộc nhau, nên tổn thương mạch máu thận có thể dẫn đến tổn thương ống thận và tổn thương ban đầu tại ống thận có thể dẫn đến tổn thương mạch máu thận. Một số nguyên nhân dẫn đến tổn thương thận cấp tại thận được trình bày trong Bảng 32-3.

Tổn thương thận cấp do viêm cầu thận
Tổn thương thận cấp là một loại AKI tại thận thường gây ra do một phản ứng miễn dịch bất thường gây tổn thương cầu thận. Trong khoảng 95% các bệnh nhân mắc bệnh này, tổn thường cầu thận thường xảy ra khoảng 1 đến 3 tuần sau nhiễm khuẩn ở một nơi bất kì trong cơ thể, thường do nhiễm liên cầu Streptococcus nhóm A tan huyết beta. Các nhiễm trùng có thể là viêm họng do liên cầu, viêm amidan do liên cầu, hoặc thậm chí nhiễm liên cầu ở da. Tự bản thân các nhiễm trùng này không gây tổn thương thận. Thay vào đó, trong vài tuần, cơ thể sản sinh ra các kháng thể chống lại các kháng nguyên liên cầu, kháng nguyên và kháng thể này kết hợp với nhau tạo thành phức hợp miễn dịch hòa tan lắng đọng ở cầu thận, đặc biệt là ở phần màng đáy cầu thận.
Khi các phức hợp miễn dịch đã lắng đọng ở cầu thận, nhiều tế bào cầu thận bắt đầu sản sinh và tăng lên nhanh chóng về số lượng, nhưng chủyếu là tế bào mesangial nằm giữa tế bào biểu mô và tế bào nội mô mao mạch cầu thận. Thêm vào đó, một lượng lớn các tế bào bạch cầu được thu hút đến cầu thận. Nhiều cầu thận bị ức chế bởi phản ứng viêm, các cầu thận còn lại không bị ức chế sẽ trở nên tăng tính thấm lên nhiều lần, cho phép cả protein và hồng cầu thoát khỏi máu ở các mao mạch cầu thận để đi vào phần nước lọc. Trong trường hợp nghiêm trọng, có thể mất hoàn toàn hoặc gần hoàn toàn chức năng thận.
Phản ứng viêm cấp tính ở cầu thận thường giảm xuống trong khoảng 2 tuần, và ở hầu hết các bệnh nhân, thận sẽ gần như trở về chức năng bình thường trong vòng vài tuần đến vài tháng. Tuy nhiên, ở nhiều người, đôi khi các cầu thận bị tổn thương sẽ không thể hồi phục và ở một tỷ lệ nhỏ bệnh nhân, quá trình tổn thương thận tiếp tục tiến triển, dẫn đến bệnh thận mạn CKD sẽ được đề cập đến trong phần tiếp theo của chương này.
Hoại tử ống thận là một nguyên nhân gây ra tổn thương thận cấp
Một nguyên nhân khác gây ra suy thận cấp tại thận là hoại tử ống thận, là tình trạng phá hủy các tế bào biểu mô của ống thận. Một số nguyên nhân thường gặp dẫn đến hoại tử ống thận là (1) thiếu máu trầm trọng dẫn đến không cung cấp đủ oxi và chất dịnh dưỡng cho thế bào biểu mô ống thận và(2) các chất độc hoặc thuốc làm phá hủy biểu mô ống thận.
Hoại tử ống thận cấp do thiếu máu nặng. Thiếu máu nặng ở thận có thể là kết quả của tình trạng sốc giảm thể tích hoặc các rối loạn khác làm giảm nghiêm trọng lượng máu tới thận. Nếu thiếu máu nặng, có thể làm suy giảm nghiêm trọng sự cung cấp các chất dinh dưỡng và oxi đến các tế bào biểu mô ống thận, và nếu tổn thương kéo dài, có thể gây phá hủy các tế bào biểu mô ống thận. Khi tổn thương này xảy ra, tế bào ống thận sẽ “bong ra” và gây bít tắc các nephron, vì vậy ở các nephron bị bít tắc sẽ không đào thải được nước tiểu, các nephron này thường không bài tiết được nước tiểu ngay cả khi dòng máu đến thận đã được phục hồi lại bình thường, bởi các tế bào ống thận bị bong ra vẫn gây bít tắc. Nguyên nhân thường gặp nhất dẫn đến thiếu máu nặng gây tổn thương các tế bào biểu mô ống thận là các nguyên nhân gây ra AKI trước thận kết hợp với sốc do giảm khối lượng tuần hoàn, như đã được thảo luận trước đó trong chương này.
Hoại tử ống thận cấp gây ra do chất độc hoặc thuốc.
Có rất nhiều các chất độc cho thận và thuốc có thể gây tổn thương biểu mô ống thận và dẫn đến AKI. Một trong số các chất đó là carbon tetrachloride, kim loại nặng (ví dụ như thủy ngân và chì), ethylene glycol (là một thành phần chính của chất chống đông), các loại thuốc trừ sâu, một số thuốc đang được sử dụng như kháng sinh (như tetracyclines), thuốc điều trị ung thư (cisplatium).
Mỗi chất này nều có những tác động có hại cụ thể trên tế bào biểu mô ống thận, dẫn đến chết nhiều tế bào trong số đó. Kết quả là, các tế bào biểu mô bong ra khỏi màng đáy và gây bít tắc các ống thận. Trong một số trường hợp, màng đáy cũng bị phá hủy. Nếu màng đáyvẫn còn nguyên vẹn, các tế bào biểu mô ống thận mới có thể phát triển dọc theo bề mặt của màng tế bào, do đó cácống thận có thể tự sửa chữa trong vòng 10 đến 20 ngày.
TỔN THƯƠNG THẬN CẤP SAU THẬN DO CÁC BẤT THƯỜNG Ở ĐƯỜNG TIỂU DƯỚI.
Các bất thường ở đường tiết niệu dưới có thể làm cản trở toàn bộ hoặc một phần dòng nước tiểu và do đó sẽ dẫn đến AKI ngay cả khi dòng máu đến thận và chức năng thận hoàn toàn bình thường. Nếu lượng nước tiểu đào thải bị giảm trên một thận duy nhất, sẽ không xảy ra các thay đổi đáng kể trong các thành phần của dịch cơ thể do thận còn lại có thể tăng đào thải nước tiểu để duy trì nồng độ các chất điện giải và các chất hòa tan trong dịch ngoại bào, cũng như lượng dịch ngoại bào ở mức tương đối bình thường. Với loại tổn thương thận này, chức năng thận bình thường có thể được phục hồi nếu nguyên nhân được giải quyết trong vòng vài giờ. Tuy nhiên, tắc nghẽn mãn tính ở đường tiết niệu kéo dài vài ngày đến vài tuần có thể dẫn đến tổn thương thận không hồi phục. Một số nguyên nhân gây ra AKI sau thận bao gồm (1) tắc nghẽn cả 2 bên niệu quản hoặc bể thận do sỏi lớn hoặc cục máu động, (2) tắc nghẽn bàng quang, và (3) tắc nghẽn niệu đạo.
CÁC BIẾN ĐỔI SINH LÝ TRONG TỔNTHƯƠNG THẬN CẤP
Một biến đổi sinh lý quan trọng trong tổn thương thận cấp đó là giữ nước, các chất thải của quá trình chuyển hóa và các chất điện giải ở trong máu cũng như dịch ngoại bào. Điều này sẽ dẫn đến sự quá tải muối và nước trong cơ thể, và do đó lần lượt sẽ dấn đến phù và tăng huyết áp. Tuy nhiên, giữ quá nhiều kali là mối đe dọa nghiêm trọng hơn cả đối với những bệnh nhân bị tổn thương thận cấp, do tăng nồng độ kali trong huyếttương (tăng kali máu) trên 8 mEq/L (gấp hơn 2 lần bìnhthường) có thể gây tử vong. Do thận không bài tiết đủ ion hydro, nên bệnh nhân AKI có thể bị nhiễm toanchuyển hóa, tình trạng này có thể gây tử vong cho bệnh nhân hoặc làm tăng kali máu trầm trọng hơn.
Hầu hết các trường hợp tổn thương thận cấp nghiêmtrọng đều xảy ra tình trạng vô niệu hoàn toàn. Bệnh nhân sẽ tử vong trong vòng 8-14 ngày, trừ khi chức năng thận được phục hồi hoặc sử dụng thận nhân tạo để đào thải khỏi cơ thể rất nhiều nước, chất điện giải và các chất thảicủa quá trình chuyển hóa đã được giữ lại. Các ảnh hưởngkhác của việc giảm đào thải nước tiểu, cũng như việcđiều trị với thận nhân tạo, sẽ được thảo luận ở phần tiếp theo liên quan đến CKD.
BỆNH THẬN MẠN THƯỜNG LIÊN QUAN ĐẾN SUY GIẢM CHỨC NĂNG THẬN KHÔNG HỒI PHỤC
CKD được định nghĩa làtình trạng tổn thương thận hoặc suy giảm chức năng thận tồn tại dai dẳng ít nhất 3 tháng. CKD thường liên quan đến quátrình tiến triển và giảmkhông hồi phục một lượng lớn các nephron chức năng.Các triệu chứng lâm sàng điển hình thường không xảy racho đến khi sốlượng các nephron chức năng giảm xuống dưới 70-75% mức bình thường. Trên thực tế, nồng độ các chất điện giải trong máu và lượng dịch trong cơ thể vẫn có thể được duy trì gần như bình thường cho tới khi số lượng các nephron chức năng giảm dưới 20-25% bình thường.
Bảng 32-4 liệt kê một số nguyên nhân chính dẫn đến CKD. Nói chung, CKD, cũng giống như AKI, cóthể xảy ra do tổn thương khởi phát ở hệ mạch thận, cầu thận,ống thận, tổ chức kẽthận hay đường niệu thấp. Mặc dù có một số lượng lớn các bệnh ngoài thận có thể dẫn tớiCKD, song hậu quả cuối cùng là như nhau – giảm số lượng các nephron chức năng.


VÒNG XOẮN BỆNH LÝ CỦA BỆNH THẬN MẠN DẪN ĐẾN BỆNH THẬN GIAI ĐOẠN CUỐI
Trong một sốtrường hợp, từtổn thương thận ban đầu sẽdẫn đến suy giảm dần chức năng thận và mất dần các nephron cho đến giai đoạn phải lọc máu hoặc ghép thận để tồn tại. Tình trạng đó được gọi là bệnh thận mạn giai đoạn cuối (ESRD).
Các nghiên cứu thí nghiệm trên động vật cho thấy khi cắt bỏ 1 phần lớn thận ban đầu sẽ dẫn đến những thay đổi thích nghi trên các nephron còn lại bao gồm: tăng lượng máu tới thận, tăng GFR và tăng đào thải nước tiểu trên các nephron còn lại. Cơ chế chính xác gây ra các thay đổi này còn chưa rõ song chủ yếu cóliên quan đến phì đại (tăng trưởng các cấu trúc khác nhau của các nephron còn lại) cũng như những thay đổi chức năng làm giảm sức cản mạch máu và giảm tái hấp thu của các nephron còn sót lại.
Những thay đổi mang tính thích nghi này cho phép cơ thể có thể đào thải lượng nước tiểu và các chất hòa tan như bình thường ngay cả khi số lượng nephron giảm xuống còn 20-25% bình thường. Trong khoảng 1 vài năm, những thay đổi thích nghi của thận sẽ dẫn đến tổn thương các nephron còn lại, đặc biệt là phần cầu thận của các nephron.
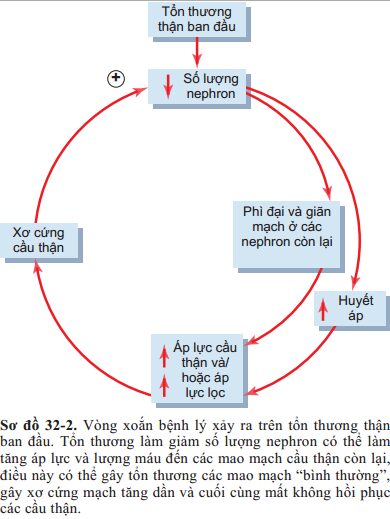
Nguyên nhân của các tổn thương thứ phát này còn chưa được hiểu đầy đủ, song 1 số nhà nghiên cứu cho rằng nó liên quan 1 phần đến sự tăng áp lực hay căng giãn quá mức của các cầu thận còn lại, điều này là hậu quả của việc giãn mạch chức năng hay tăng lượng máu qua thận. Sự tăng mạn tính áp lực ở các tiểu động mạch và cầu thận được cho là nguyên nhân làm tổn thương và xơ cứng các mạch máu (thay thế mô bình thường bằng mô liên kết). Các tổn thương xơ này có thể dẫn đến bít tắc cầu thận, từ đó làm suy giảm chức năng thận và tiếp tục dẫn đến các thay đổi thích nghi của các nephron còn lại, quá trình này cứ lặp đi lặp lại tạo thành một vòng xoắn bệnh lý tiến triển chậm và cuối cùng kết thúc bằng bệnh thận mạn giai đoạn cuối-ESRD (Hình 32-2). Biện pháp hiệu quả nhất để làm chậm lại quá trình suy giảm chức năng thận này là giảm huyết áp động mạch và giảm áp lực ở cầu thận, đặc biệt bằng việc sử dụng các thuốc như ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin II.
Bảng 32-5 liệt kê các nguyên nhân hay gặp nhất dẫn tới ESRD. Đầu những năm 1980, viêm cầu thận được cho là nguyên nhân quan trọng nhất dẫn ESRD. Trong những năm gần đây, đái tháo đường và tăng huyết áp được công nhận là 2 nguyên nhân hàng đầu dẫn đến ESRD, chiếm tổng cộng 70% số bệnh nhân ESRD.

Tăng cân (béo phì) là yếu tố nguy cơ quan trọng nhất đối với 2 nguyên nhân chính của ESRD – đái tháo đường và tăng huyết áp. Như đã được thảo luận trong chương 79, đái tháo đường type II có mối liên quan chặt chẽ với bệnh béo phì (chiếm hơn 90% tất cả các trường hợp đái tháo đường). Tăng cân cũng là một nguyên nhân lớn dẫn đến tăng huyết áp, chiếm khoảng 65-75%các yếu tố nguy cơ dẫn đến tăng huyết áp ở người trưởng thành. Ngoài việc gây tổn thương thận qua bệnh tiểu đường và tăng huyết áp, béo phì còn góp phần làm xấu đi chức năng thận trên bệnh nhân đã có bệnh thận nền ban đầu.
TỔN THƯƠNG MẠCH MÁU THẬN LÀ MỘT NGUYÊN NHÂN DẪN ĐẾN BỆNH THẬN MẠN
Nhiều loại tổn thương mạch máu có thể gây thiếu máu thận và gây chết mô thận. Các tổn thương thường gặp nhất là (1) Xơ vữa các động mạch lớn của thận, với quá trình xơ cứng tiến triển gây co khít các mao mạch; (2) tăng sản sợi cơ ở một hoặc nhiều động mạch lớn, gây tắc các mạch máu ; và (3) xơ cứng thận, do tổn thương xơ cứng các động mạch nhỏ, tiểu động mạch và cầu thận.
Tổn thương xơ vữa hoặc tăng sản của các động mạch lớn thường chỉ ảnh hưởng tới 1 thận và do đó làm giảm đơn thuần chức năng một thận. Như đã được thảo luận ở chương 19, tăng huyết áp thường xảy ra khi động mạchở một thận bị chèn ép trong khi động mạch ở thận còn lạivẫn bình thường, một tình trạng tương tự như thí nghiệm về tăng huyết áp trên hai thận của Goldblatt.
Xơ cứng thận lành tính, hình thức phổ biến nhất của bệnh thận, được tìm thấy ở ít nhất 70% các trường hợp giám định pháp y của những người chết ở 60 tuổi. Đây là loại tổn thương mạch máu xảy ra ở những động mạch gian thùy nhỏ và các tiểu động mạch hướng tâm của thận. Đây được cho là nơi bắt đầu quá trình thoát huyết tương qua các tế bào nội mô mạch máu. Quá trình thoát mạch này làm lắng đọng fibrin vào lớp trung gian giữa các mạch máu, theo sau đó là quá trình dày thành mạch mà cuối cùng dẫn đến tình trạng co thắt mạch, và trong một số trường hợp có thể dẫn đến bít tắc mạch hoàn toàn. Do không có các nhánh nối thông giữa các mạch máu nhỏ của thận, nên khi tắc một trong số chúng sẽ dẫn đến hủy hoại một số lượng nephron tương ứng được cấp máu. Vì vậy, một phần nhu mô thận sẽ bị thay thế bởi mô xơ. Khi quá trình xơ hóa xảy ra ở cầu thận, tổn thương đó sẽ được gọi là xơ hóa cầu thận.
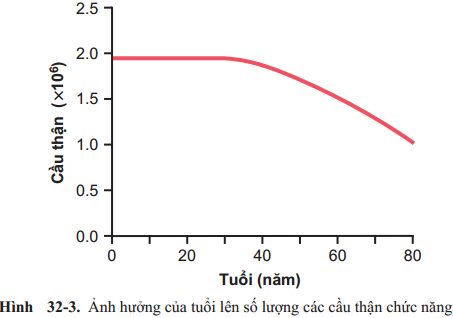
Xơ hóa thận và xơ hóa cầu thận trong một giới hạn nào đó thường xảy ra ở những người sau 40 tuổi, dẫn đến sự giảm 10% các nephron chức năng trong 10 năm bắt đầu từ năm 40 tuổi (Hình 32-3). Sự mất cầu thận và chức năng của các nephron được phản ảnh bằng việc giảm từ từ cả lượng máu tới thận và GFR. Ngay cả ở những người khỏe mạnh không có tăng huyết áp hay đái tháo đường tiềm ẩn, lượng huyết tương qua thận và GFR sẽ giảm 40-50% khi đến tuổi 80.
Tần suất và mức độ xảy ra xơ hóa thận và xơ hóa cầu thận được tăng lên rất nhiều nếu có đi kèm tăng huyết áp hoặc đái tháo đường. Trên thực tế, đái tháo đường và tăng huyết áp là hai nguyên nhân quan trọng nhất dẫn đến ESRD, như đã được thảo luận ở trước. Như vậy, xơ hóa thận lành tính kết hợp với tăng huyết áp nặng có thể dẫn đến xơ hóa thận ác tính tiến triển nhanh. Các đặc điểm mô học đặc trưng cho xơ hóa thận ác tính bao gồm một lượng lớn fibrin lắng đọng trong các tiểu động mạch và quá trình dày thành mạch, với thiếu máu nghiêm trọng ở các nephron bị ảnh hưởng. Ngoài ra, tuy chưa tìm ra lí do nhưng người ta nhận thấy tỷ lệ mắc xơ hóa thận và xơ hóa cầu thận ác tính ở người da đen cao hơn người da trắng ở cùng độ tuổi và cùng mức độ mắc tăng huyết áp hoặc đái tháo đường.
TỔN THƯƠNG CẦU THẬN LÀ NGUYÊN NHÂN DẪN ĐẾN BỆNH THẬN MẠN – VIÊM CẦU THẬN
Viêm cầu thận mạn được gây ra do các bệnh lý gây viêm và làm tổn thương cuộn mao mạch cầu thận. Khác với viêm cầu thận cấp, viêm cầu thận mạn là một bệnh tiến triển chậm và thường dẫn tới suy thận không hồi phục. Nó có thể là bệnh thận ban đầu, hoặc có thể là tổn thương thứ phát sau các bệnh hệ thống, ví dụ như lupus ban đỏ hệ thống.
Trong hầu hết các trường hợp, viêm cầu thận mạn thường khởi phát với sự tăng lắng đọng các phức hợp kháng nguyên – kháng thế ở màng đáy cầu thận. Trái ngược với viêm cầu thận cấp, số lượng bệnh nhân nhiễm liên cầu chỉ chiếm một phần nhỏ trong tổng số bệnh nhân bị viêm cầu thận mạn. Sự tích lũy phức hợp kháng nguyên – kháng thể ở màng đáy cầu thận gây ra phản ứng viêm tại chỗ, làm dày màng đáy và cuối cùng dẫn đến xơ hóa cầu thận. Ở giai đoạn sau của bệnh, hệ số lọc ở các mao mạch cầu thận bắt đầu giảm do sự giảm số lượng các mao mạch lọc ở các búi mạch cầu thận. Trong giai đoạn cuối của bệnh, rất nhiều cầu thận bị thay thể bởi mô xơ và do đó không thể tạo ra dịch lọc.
TỔN THƯƠNG KẼ THẬN LÀ NGUYÊN NHÂN DẪN ĐẾN BỆNH THẬN MẠN – VIÊM THẬN KẼ
Tổn thương tiên phát hoặc thứ phát ở kẽ thận có liên quan đến bệnh viêm thận kẽ. Nhìn chung, tình trạng này thường là kết quả của tổn thương mạch máu, cầu thận hoặc ống thận gây tổn thương các nephron, hoặc nó có thể liên quan đến tổn thương ban đầu ở kẽ thận do các chất độc, thuốc hay nhiễm khuẩn.
Tổn thương kẽ thận do nguyên nhân nhiễm khuẩn được gọi là viêm thận-bể thận. Tình trạng nhiễm khuẩn có thể do nhiều loại vi khuẩn khác nhau nhưng thường gặp nhất là E.coli do nhiễm khuẩn ngược dòng từ đường hậu môn. Những vi khuẩn này sẽ vào thận bằng đường máu hoặc thường gặp hơn là từ đường tiết niệu dưới theo niệu quản lên thận.
Mặc dù bàng quang bình thường có thể làm sạch vi khuẩn một cách dễ dàng, nhưng có 2 tình trạng trên lâm sàng có thể làm cản trở quá trình này của bàng quang: (1) bàng quang không có khả năng làm rỗng hoàn toàn, để lại nước tiểu còn sót lại trong bàng quang, và (2) tắc nghẽn đường ra của nước tiểu. Với việc suy giảm khả năng rửa sạch vi khuẩn của bàng quang, vi khuẩn sẽ nhân lên và bàng quang sẽ bị nhiễm khuẩn, một tình trạng gọi là viêm bàng quang.
Một khi viêm bàng quang đã xảy ra, nó có thể vẫn khu trú mà không phát triển lên thận, hoặc ở một số người, vi khuẩn có thể lên đến bể thận do có một tình trạng bệnh lý nào đó làm nước tiểu trào ngược lên 1 hoặc cả 2 niệu quản trong quá trình tiểu tiện. Tình trạng này được gọi là trào ngược bàng quang niệu quản do thành bàng quang không có khả năng bịt kín niệu quản trong quá trình tiểu tiện, kết quả là, một phần nước tiểu bị đẩy lên thận, mang theo vi khuẩn lên bể thận và tủy thận, nơi chúng bắt đầu quá trình nhiễm khuẩn và gây viêm được gọi là Viêm bể thận.
Viêm bể thận thường bắt đầu từ vùng tủy thận và thường ảnh hưởng đến chức năng phần tủy nhiều hơn phần vỏ thận, ít nhất là trong giai đoạn đầu. Do một trong các chức năng chính của tủy thận là tham gia cơ chế điều hòa ngược trong quá trình cô đặc nước tiểu, nên bệnh nhân bị viêm bể thận thường bị suy giảm rõ rệt khả năng cô đặc nước tiểu.
Với viêm bể thận lâu ngày, sự lan tràn ở thận của vi khuẩn không chỉ làm tổn thương tủy thận mà còn gây tổn thương tiến triển trên các ống thận, cầu thận và các cấu trúc khác ngoài thận. Hậu quả là, phần lớn các mô thận bị mất chức năng và CKD có thể phát triển.
HỘI CHỨNG THẬN HƯ – XUẤT HIỆN PROTEIN NIỆU DO SỰ TĂNG TÍNH THẤM CỦA CẦU THẬN
Hội chứng thận hư,được đặc trưng bởi tình trạng mất một lượng lớn protein huyết tương qua nước tiểu, được hình thành ở nhiều bệnh nhân có bệnh thận. Trong một số trường hợp, hội chứng này có thể xảy ra mà không có bằng chứng về sự bất thường chức năng thận, nhưng nó thường gặp trong một số mức CKD.
Nguyên nhân dẫn đến việc tăng mất protein qua nước tiểu là do sự tăng tính thấm của màng đáy cầu thận. Vì vậy, các bệnh gây tăng tính thấm màng đáy cầu thận có thể gây hội chứng thận hư. Một số bệnh bao gồm: (1) viêm cầu thận cấp, thường ảnh hưởng chủ yếu trên cầu thận và thường gây tăng tính thấm của màng đáy cầu thận lên rất nhiều lần; (2) bệnh thoái hóa tinh bột-amyloidosis,kết quả của sự lắng đọng chất proteinoid bất thường lên thành mạch và tổn thương nặng the basement membrane của cầu thận; và (3) hội chứng thận hư thay đổi tối thiểu,khi không có các bất thường lớn ở màng đáy mao mạch cầu thận có thể phát hiện được bằng kính hiển vi quang học. Như đã được thảo luận ở Chương 27, hội chứng thận hư thay đổi tối thiểu được tìm ra có liên quan với việc mất các điện tích âm bình thường hiện diện ở màng đáymao mạch cầu thận. Các nghiên cứu về miễn dịch học cũng đã chỉ ra những phản ứng miễn dịch bất thường trong một số trường hợp, cho thấy việc mất điện tích âm có thể là kết quả của việc các kháng thể tấn công màng đáy. Mất điện tích âm ở màng đáy mao mạch cầu thận cho phép protein, đặc biệt là albumin qua màng cầu thận một cách dễ dàng do các điện tích âm trên màng đáy cầu thận bình thường sẽ đẩy các protein mang điện tích âm.
Hội chứng thận hư thay đổi tối thiểu có thể xảy ra ở người lớn, nhưng thường xảy ra nhiều hơn ở trẻ em từ 2-6 tuổi. Tăng tính thấm của màng đáy mao mạch cầu thận có thể làm cho mất tới 40g protein huyết tương qua nước tiểu mỗi ngày, đó là lượng protein rất lớn đối với một đứa trẻ. Vì vật, nồng độ protein huyết tương của trẻ thường giảm dưới 2g/dl và áp lực keo của huyết tương thường giảm dưới mức bình thường là 28 cho đến dưới 10 mmHg. Hậu quả của việc giảm áp lực keo trong huyết tương là một lượng lớn dịch sẽ bị rò rỉ từ mạch máu vào các mô trong cơ thể, gây ra phù, đã được thảo luận ở chương 25.
NEPHRON CHỨC NĂNG TRONG BỆNH THẬN MẠN
Mất các nephron chức năng đòi hỏi các nephron còn lại phải bài tiết nhiều hơn nước và các chất hòa tan. Sẽ là hợp lí khi cho rằng khi giảm số lượng các nephron chức năng, sẽ làm giảm GFR, cũng sẽ gây giảm bài tiết nước và các chất hòa tan qua thận. Tuy nhiên bệnh nhân đã mất đến 75-80% nephron vẫn có thể bài tiết được lượng nước và chất điện giải như bình thường mà không bị ứ dịch hay các chất hòa tan nghiêm trọng trong dịch cơ thể. Tuy nhiên, khi giảm hơn nữa số lượng các nephron, sẽ dẫn đến ứ dịch và các chất tan trong cơ thể, và tử vong thường xảy ra khi số lượng nephron giảm dưới 5-10% bình thường.
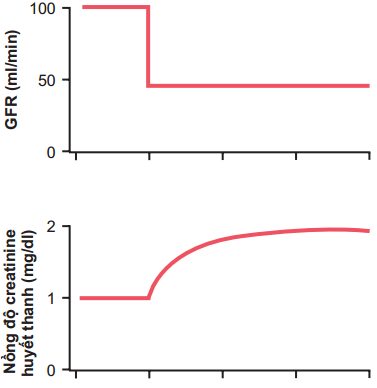
Ngược lại với các chất điện giải, rất nhiều các chất thải của quá trình chuyển hóa, ví dụ như ure và creatinin, hầu hết được giữ lại trong cơ thể tương đương với số lượng các nephron bị phá hủy. Lí do để giải thích điều này là sự bài tiết các chất như creatinin và ure phần lớn phụ thuộc vào quá trình lọc ở cầu thận, và các chất này không được tái hấp thu giống như các chất điện giải.
Ví dụ như Creatinine, không được tái hấp thu tất cả, và độ bài tiết gần như tỷ lệ thuận với độlọc của nó.
Độ lọc Creatinin= GFR x Nồng độ creatinin trong huyết tương= Tỷ lệ bài tiết Creatinin
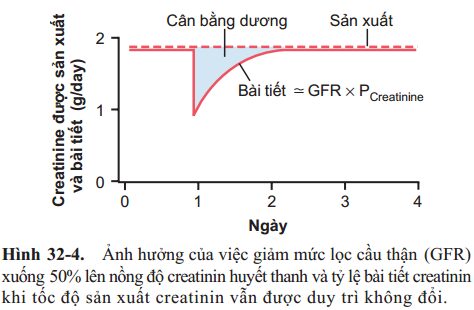
Do đó, nếu GFR giảm, tỷ lệ bài tiết creatinin cũng giảm thoáng qua, gây ra sự tích lũy của creatinin trong dịch cơ thể và tăng nồng độ trong huyết tương cho đến khi tỷ lệ bài tiết creatinine trở lại bình thường – tương tự như tỷ lệ creatinin được tiết ra trong cơ thể (Hình 32-4). Như vậy, trong điều kiện ổn định, tỷ lệ bài tiết creatinin bằng với tỷ lệ sản xuất creatinine, mặc dù GFR giảm. Tuy nhiên, tỷ lệ bài tiết creatinin bình thường xảy ra tại thời điểm nồng độ creatinin huyết tương cao, như thể hiện trong đường A Hình 32-5.
Một số chất tan, như phosphat, urat, và ion hydro, thường được duy trì ở mức gần bình thường cho đến khi GFR giảm dưới mức 20-30% bình thường. Sau đó, nồng độ trong huyết tương của các chất này tăng lên, nhưng không tương xứng với sự giảm GFR, thể hiện trong đường B Hình 32-5. Duy trì liên tục nồng độ các chất tan này trong huyết tương khi GFR giảm được thực hiện bằng cách bài tiết theo cấp tăng dần lượng các chất tan được lọc ở cầu thận, điều này xảy ra bằng cách giảm tỷ lệ tái hấp thu ở ống thận, hoặc trong một vài trường hợp, bằng cách tăng bài tiết ở ống thận.
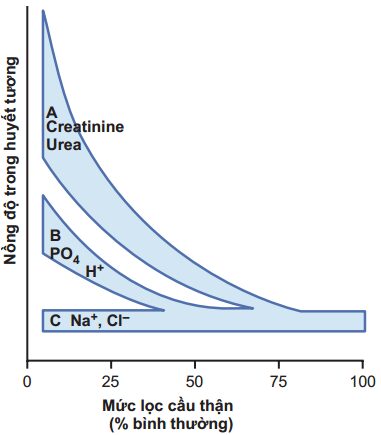

Trong trường hợp của các ion Natri và clo, nồng độ trong huyết tương của chúng được duy trì gần như không đổi ngay cả khi giảm trầm trọng GFR (nhìn đường C trong Hình 32-5). Sự duy trì này được thực hiện bằng cách giảm mạnh sự tái hấp thu các chất điện giải này ở ống thận.
Ví dụ, khi mất 75% các nephron chức năng, mỗi nephron còn lại phải bài tiết lượng natri và lượng nước tiểu gấp 4 lần bình thường (Bảng 32-6).
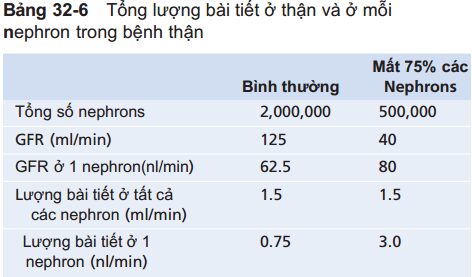
Một phần của sự đáp ứng này xảy ra do tăng lượng máu đến và tăng GFR ở mỗi nephroncòn lại, do sự phì đại của các mạch máu và cầu thận, cũng như thay đổi chức năng do giãn mạch. Ngay cả khi giảm mạnh GFR toàn phần sự bài tiết bình thường ở thận vẫn có thể được duy trì bằngcách giảm tốc độ tái hấp thu nước và các chất hòa tan ở ống thận.
Đồng tỷ trọng niệu—Thận không có khả năng cô đặc và pha loãng nước tiểu. Một ảnh hưởng quan trọng trên các nephron còn lại của ống thận khi tốc độ dòng chảy qua ống thận quá nhanh đó là ống thận mất khả năng cô đặc hay làm loãng nước tiểu. Khả năng cô đặc nước tiểu của thận bị suy giảm chủ yếu do: (1) lượng dịch chảy qua ống thận quá nhanh khi qua ống góp làm cản trở quá trình tái hấp thu nước và (2) dòng chảy quá nhanh qua quai Henle và ống góp làm cản trở hoạt động của cơ chế nhân nồng độ ngược dòng nhằm tập trung các chất tan vào dịch kẽ tủy. Vì vậy, Tương ứng với các nephron bị phá hủy, khả năng cô đặc nước tiểu tối đa của thận giảm và độ thẩm thấu và tỷ trọng nước tiểu(đo tổng cộng nồng độ của các chất hòa tan) sẽ đi gần tới giá trị của độ thẩm thấu và tỷ trọng của dịch lọc, được trình bày trong Hình 32-6.
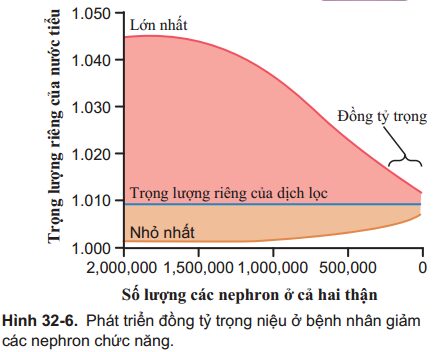
Cơ chế pha loãng nước tiểu của thận cũng bị suy yếu khi giảm rõ rệt số lượng các nephron, do dịch máu qua quai Henle nhanh và nồng độ cao các chất tan như uredẫn đến nồng độ khá cao các chất tan trong dịch ống thận ở mỗi phần nephron. Với kết quả của quá trình trên, khả năng pha loãng của thận sẽ bị suy giảm và độ thẩm thấu và tỷ trọng nhỏ nhất của nước tiểu sẽ gần bằng với giá trị đó của dịch lọc. Do cơ chế cô đặc nước tiểu bị suy giảm nhiều hơn so với cơ chế pha loãng trong CKD, một test lâm sàng quan trọng trên thận để đánh giá khả năng cô đặc nước tiểu của thận là hạn chế lượng nước uống của một người trong vòng 12h hoặc hơn.
Ảnh hưởng của suy thận lên lượng dịch trong cơ thể-Chứng tăng ure huyết
Tác động của CKD lên lượng dịch cơ thể phụ thuộc vào (1) lượng nước uống và thức ăn, (2) mức độ suy giảm chức năng thận. Giả sử rằng một người bị suy thận hoàn toàn ăn vào lượng nước và thức ăn như bình thường, sự tập trung các chất trong dịch ngoài bào được ước tính như trong Sơ đồ 32-7. Những tác động quan trọng bao gồm (1) phù toàn thân kết quả của việc giữ muối nước; (2) nhiễm toan kết quả của suy giảm chức năng thận trong việc đào thải khỏi cơ thể các chất acid; (3 ) nồng độ cao các hợp chất nitơ non-protein—đặc biệt là ure, creatinin, và acid uric-kết quả của việc suy giảm chức năng bài tiết các chất trung gian và sản phẩm chuyển hóa protein; and (4) nồng độ cao của các chất khác được bài tiết bởi thận, bao gồm: phenol, sulfat, phosphat, kali, và base guanidine. Tất cả những tình trạng này được gọi là hội chứng nhiễm ure huyết do nồng độ cao của ure trong các dịch cơ thể.
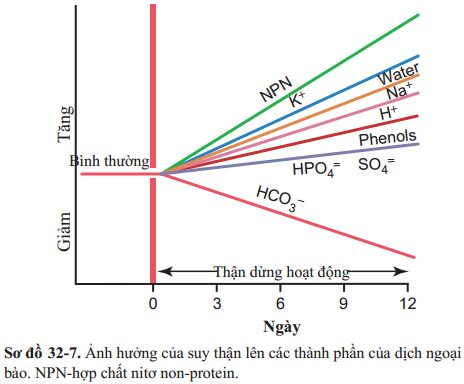
Giữ nước và hình thành phù trong bệnh thận mạn. Nếu lượng nước được hạn chế ngay sau khi bắt đầu xuất hiện tổn thương thận cấp, tổng lượng dịch trong cơ thể có thể chỉ tăng nhẹ. Nếu lượng dịch vào cơ thể không được giới hạn và bệnh nhân uống theo nhu cầu bình thường, dịch trong cơ thể ngay lập tức sẽ tăng lên nhanh chóng.
Với CKD, nếu như lượng muối và dịch vào không quá nhiều, dịch tích lũy trong cơ thể sẽ không nhiều cho đến khi chức năng thận giảm xuống dưới 25% bình thường. Để lý giải cho điều này, như đã được thảo luận trước đây, các nephron còn lại vẫn bài tiết một lượng lớn muối và nước. Dù cơ thể chỉ giữ lại một ít dịch, nhưng cùng với việc tăng bài tiết renin và angiotensin II thường xảy ra trong thiếu máu cục bộ ở thận, có thể dẫn đến tăng huyết áp nặng ở bệnh nhân CKD. Tăng huyết áp phát triển ở hầu hết các bệnh nhân giảm chức năng thận, và lọc máu là việc cần thiết để đảm bảo tính mạng bệnh nhân. Ở rất nhiều bệnh nhân, giảm triệt để lượng muối ăn cùng với loại bỏ dịch ngoại bào bằng lọc máu có thể giúp kiểm soát tăng huyết áp. Các bệnh nhân vẫn còn tăng huyết áp ngay cả khi đã loại bỏ một lượng lớn natri nhờ lọc máu. Trong nhóm này, việc loại bỏ thận bị thiếu máu cục bộ sẽ điều chỉnh được tăng huyết áp (với điều kiện hạn chế giữ dịch trong cơ thể bằng lọc máu) vì nó loại bỏ được nguồn gốc của việc tiết quá nhiều renin và tăng hình thành angiotensin II.
Tăng ure và các hợp chất chưa nitơ không phải protein (chứng tăng ure huyết). Các chất chưa nitơ không phải protein bào gồm: urea, acid uric, creatinin, và một số các hợp chất không quan trọng khác. Những hộ chất nitơ nonprotein này, là những sản phẩm chuyển hóa cuối cùng của quá trình chuyển hóa protein và phải được loại bỏ khỏi cơ thể để đảm bảo quá trình chuyển hóa protein liên tục của tế bào. Nồng độ của các chất nitơ nonprotein, đặc biệt là ure, có thể tăng cao gấp 10 lần trong vòng 1-2 tuần ở bệnh nhân suy thận toàn bộ. Với CKD, nồng độ các chất tăng lên tương ứng với mức độ suy giảm của các nephron chức năng. Vì lí do này, đo nồng độ các chất, đặc biệt là ure vàcreatinine, cungcấp thông tin quan trọng cho việc đánh giá mức độ nặng của CKD.
Nhiễm toan trong bệnh thận mạn. Mỗi ngày, cơ thể sản xuất acid chuyển hóa nhiều hơn kiềm chuyển hóa từ 50-80 mmol. Vì vậy, khi thận suy giảm chức năng, acid sẽ tích lũy nhiều trong các dịch cơ thể. Các hệ đệm trong các dịch cơ thể có thể đệm từ 500 đến 1000 mmol acid để nồng độ H+ trong dịch ngoài bào không tăng đến mức gây tử vong, và các hợp chất phosphattrong xương có thể đệm thêm đến vài ngàn mmol H+. Tuy nhiên, khi các chất đệm được sử dụng hết, pHmáu sẽ giảm mạnh và bệnh nhân có thể rơi vào tình trạng hôn mê hoặc tử vong nếu pH giảm dưới 6.8.
Thiếu máu trong suy thận mạn do giảm bài tiết Erythropoietin. Thiếu máu thường xuất hiện ở những bệnh nhân bị CKD nặng. Nguyên nhân quan trọng nhất dẫn đến thiếu máu là do thận giảm bài tiết erythropoietin, chất kích thích tủy xương sản xuất hồng cầu. Nếu thận bị tổn thương nghiêm trọng, chúng không thể sản xuất đủ số lượng erythropoietin, điều đó dẫn đến giảm số lượng tế bào hồng cầu và kết quả cuối cùng là thiếu máu.
Từ năm 1989 erythropoietin tái tổ hợp đã được sản xuất nhằm hỗ trợ điều trị thiếu máu ở những bệnh nhân suy thận mạn.
Loãng xương ở bệnh thận mạn do giảm sản xuất Vitamin D hoạt động và khả năng duy trì Photphat của thận. CKD kéo dài cũng gây loãng xương, một tình trạng trong đómột phần của xương bị hấp thụ trở lại và do nó trở nên yếu đi. Nguyên nhân quan trọng nhất dẫn đến tình trạng này là do: Viatmin D được chuyển hóa bởi một quá trình gồm 2 giai đoạn, giai đoạn đầu tiên ở gan và sau đó ở thận, nó được chuyển thành dạng 1,25dihydroxycholecalciferol trước khi tham gia thúc đẩy quá trình hấp thụ calci từ ruột. Do đó, tổn thương thận nghiêm trọng làm giảm nồng độ Vitamin D hoạt động trong máu, do đó làm giảm hấp thu calci từ ruột và giảm calci trong xương.
Một nguyên nhân quan trọng của khử khoáng của xương trong CKD là do sự tăng nồng độ phosphate trong huyết thanh do GFR giảm. Sự tăng photphat trong huyết thanh làm tăng gắn phosphate với canxi trong huyết tương, do đó làm giảm nồng độ ion calci trong huyết tương, qua đó kích thích bài tiết hormone tuyến cận giáp. Cường cận giáp thứ này phát kích thích sự giải phóng canxi từ xương, gây khử khoáng xương hơn nữa.
Tăng huyết áp và bệnh thận
Như đã được thảo luận ở đoạn trước của chương này, tăng huyết áp làm trầm trọng thêm tổn thương ở cầu thận và mạch máu thận và là nguyên nhân chính dẫn đến ESRD. Các bất thường chức năng thận có thể dẫn đến tăng huyết áp, như đã được thảo luận chi tiết ở Chương 19. Vì vậy, có mối liên quan giữa bệnh thận và tăng huyết áp, trong một vài trường hợp, có hình thành một vòng xoắn bệnh lý: tổn thương thận ban đầu dẫn đến tăng áp lực trong mạch máu, điều này lại làm t áp, điều này cứ lặp đi lặp lại cho đến khi hình thành ESRD.
Không phải tất cả các bệnh thận đều dẫn tới tăng huyết áp do tổn thương một số phần xác định của thận dẫn tới hội chứng tăng ure huyết không tăng huyết áp. Tuy nhiên, một số tổn thương thận có nguy cơ cao gây tăng huyết áp. Phân loại bệnh thận có hay không kèm theo tăng huyết áp sẽ được đề cập đến trong các phần tiếp theo.
Các tổn thương thận làm giảm khả năng bài tiết Natri và nước, góp phần làm tăng huyết áp.
Các tổn thương thận làm giảm khả năng bài tiết Natri và nước, hầu như luôn luôn dẫn đến tăng huyết áp. Vì vậy, các tổn thương làm giảm GFR hoặc tăng tái hấp thu ở ống thận thường dẫn tới tăng huyết áp với nhiều mức độ khác nhau.
Một số bất thường thận cụ thể có thể dẫn tới tăng huyết áp được liệt kê dưới đây:
- Tăng sức cản mạch thận, làm giảm lượng máu tới thận và giảm GFR. Một ví dụ là hẹp động mạch thận gây tăng huyết áp.
- Giảm hệ số lọc ở mao mạch cầu thận, từ đó làm giảm GFR. Một ví dụ là trong bệnh viêm cầu thận mạn, dẫn tới hình thành phản ứng viêm và làm dày màng đáy mao mạch cầu thận, từ đó làm giảm hệ số lọc ở mao mạch cầu thận.
- Tái hấp thu quá mức Natri ở ống thận. Một ví dụ là tăng huyết áp do bài tiết quá mức aldosterone, làm tăng tái hấp thu Natri, đặc biệt ở ống góp.
Một khi đã hình thành tăng huyết áp, sự bài tiết nước và Natri của thận trở về bình thường do áp lực cao trong động mạch sẽ làm tăng lợi tiểu và tăng Natri trong nước tiểu ngay lập tức nên lượng Natri và nước vào – ra của cơ thể sẽ trở lại cân bằng một lần nữa. Ngay cả khi sức cản mao mạch thận tăng nhiều hoặc giảm hệ số lọc của cầu thận, GFR vẫn có thể trở về mức gần như bình thường sau những lần tăng huyết áp. Tương tự như vậy, khi tái hấp thu ở ống thận tăng, xảy ra khi bài tiết quá mức aldosterone, the urinary excretion rate is initially reduced nhưng sau đó trở về bình thường sau những lần tăng huyết áp. Do đó, sau mỗi lần tăng huyết áp tiến triển, có thể sẽ không có những dấu hiệu của việc suy giảm chức năng bài tiết Natri và nước so với lúc tăng huyết áp trước. Như đã được giải thích ở Chương19, sự bài tiết Natri và nước bình thường khi huyết áp đang cao có nghĩa là nước và Natri trong nước tiểu đã được điều chỉnh lại ngay bởi lần tăng huyết áp tiến triển.
Tăng huyết áp do tổn thương thận không đồng đều và tăng bài tiết Renin. Nếu một phần của thận bị thiếu máu cục bộ và phần còn lại không bị thiếu máu, xảy ra khi một động mạch thận bị co thắt, mô thận bị thiếu máu sẽ tiết ra một lượng lớn renin. Sự bài tiết này sẽ làm tăng hình thành angiotensinII, từ đó có thể dẫn đến tăng huyết áp. Chuỗi các phản ứng tiếp theo của cơ thể để dẫn đến tăng huyết áp đã được thảo luận trong Chương 19, đó là (1) nhu mô thận bị thiếu máu sẽ bài tiết lượng nước và muối ít hơn bình thường ;(2) renin được bài tiết bởi mô thận thiếu máu, tiếp theo sau đó là tăng hình thành angiotensin II, từ đó tác động lên mô thận không thiếu máu dẫn đến tăng giữ muối và nước; và (3) theo bình thường, tăng giữ muối nước quá mức dẫn đến tăng huyết áp.
Một loại tăng huyết áp tương tựlà do việc thiếu máu không đồng đều ở các phần của thận, đây là kết quả của xơ cứng mạch thận hoặc tổn thương mạch ở những vị trí đặc biệt của thận. Khi điều này xảy ra, các nephron thiếu máu sẽ bài tiết ít muối và nước nhưng bài tiết lượng renin nhiều hơn, dẫn đến tăng hình thành angiotensin II. Angiotensin II tăng cao sẽ làm suy giảm chức năng của các phần xung quanh, cụ thể là làm suy giảm chức năng của các nephron bình thường trong việc bài tiết nước và Natri. Kết quả cuối cùng là hình thành tăng huyết áp, từ đó khôi phục lại toàn bộ chức năng thận trong bài tiết nước và Natri, cân bằng lượng muối và nước vào-ra sẽ được duy trì, nhưng ở thời điểm huyết áp cao.
Các bệnh thận làm tổn thương toàn bộ nephron, dẫn đến bệnh thận mạn nhưng có thể không dẫn đến tăng huyết áp.
Mất một lượng lớn các nephron, xảy ra khi mất một thận và một phần của thận còn lại, hầu hết thường dẫn đến CKD nếu lượng nhu mô thận bị mất đi đủ lớn. Nếu các nephrron còn lại bình thường và lượng muối cơ thể nhận vào không quá lớn, tình trạng này có thể không dẫn đến các triệu chứng lâm sàng của tăng huyết áp bởi sự tăng huyết áp từ từ sẽ dấn đến tăng GFR và giảm tái hấp thu Natri ở ống thận ở các nephron còn lại để thúc đẩy bài tiết đủ muối và nước ra nước tiểu, ngay cả với số lượng ít các nephron nguyên vẹn còn lại. Tuy nhiên, bệnh nhân với loại bất thường này có thể có cơn tăng huyết áp kịch phát nếu có xuất hiện các yếu tố stress, ví dụ ăn một lượng muối lớn. Trong trường hợp này, thận không thể đào thải hết lượng muối để duy trì huyết áp bình thường chỉ với một lượng nhỏ các nephron chức năng còn lại. Tăng huyết áp sẽ giúp phục hồi lượng bài tiết muối nước để phù hợp với lượng đưa vào nhằm đưa cơ thể trở về trạng thái ổn định.
Hiệu quả điều trị tăng huyết áp phụ thuộc vào việc tăng khả năng bài tiết muối và nước của thận, hoặc tăng GFR hoặc giảm tái hấp thu của ống thận, để cân bằng giữa lượng muối nước vào và bài tiết có thể duy trì được ở huyết áp thấp hơn. Hiệu quả này có thể đạt được nhờ các thuốc ức chế tín hiệu thần kinh và các hormon giữ muối nước ( vd., thuốc ức chế βadrenergic, kháng recepter của angiotensin, hoặc thụ thể enzym chuyển angiotensin), hoặc các thuốc giãn mạch thận và tăng GFR(vd, chẹn kênh canxi..) hoặc các thuốc lợi tiểu trực tiếp ức chế việc tái hấp thu muối và nước ở ống thận.
Các rối loạn cụ thể ở ống thận
Trong chương 28, chúng tôi đã chỉ ra các cơ chế tham gia vào quá trình vận chuyển các chất khác nhau qua màng biểu mô ống thận. Trong Chương 3, chúng tôi cũng chỉ ra rằng mỗi enzym tế bào và mỗi protein mang được hình thành do sự đáp ứng với một gen tương ứng trong nhân tế bào. Nếu bất kì gen cần thiết nào bị mất hay xảy ra bất thường, các ống thận có thể thiếu hụt một trong các protein vận chuyển hoặc một trong số các enzym cần cho việc vận chuyển các chất tan qua biểu mô tế bào ống thận. Trong các trường hợp khác, có quá nhiều enzym hoặc protein vận chuyển được sản xuất. Vì vậy, nhiều rối loạn ống thận di truyền xảy ra do bất thường quá trình vận chuyển các chất hoặc nhóm chất qua màng ống thận. Ngoài ra, tổn thương màng biểu mô ống thận do các chất độc hoặc thuốc có thể gây ra các rối loạn nghiêm trọng ở ống thận.
Glucose niệu—Suy giảm chức năng thận trong tái hấp thu Glucose. Trong trường hợp glucose niệu tăng, đường máu có thể bình thường, nhưng cơ chế tái hấp thu glucose của ống thận có thể bị giới hạn hoặc mất. Kết quả là, mặc dù lượng glucose trong máu bình thường, nhưng một lượnglớn glucose vẫn thoát qua nước tiểu hằng ngày. Do bệnh đái tháo đường cũng gây xuất hiện glucose trong nước tiểu, nhưng đây là một tình trạng lành tính, cần thiết phải loại bỏ các nguyên nhân trên trước khi chẩn đoán bệnh nhân bị đái tháo đường.
Aminoaciduria—Suy giảm chức năng thận trong tái hấp thu Amino Acid. Một số amino acids được tái hấp thu qua cùng hệ thống vận chuyển, trong khi các amino acid khác có hệ thống vận chuyển riêng. Hiếm khi, một tình trạng được gọi là generalized aminoaciduria là kết quả của việc tái hấp thu không đủ tất cả các amino acid; thường gặp hơn, sự thiếu hụt các kênh vận chuyển đặc hiệu có thể dẫn đến kết quả (1) cystine niệu, một lượng lớn cystine không được tái hấp thu và thường kết tinh trong nước tiểu để hình thành sỏi thận; (2) glycin niệu, không tái hấp thu glycin; hoặc (3) acid beta-amino isobutyric niệu, xảy ra ở khoảng 5% dân số nhưng không có biểu hiện trên lâm sàng.
Hạ photphat máu do thận-Suy giảm chức năng thận trong việc tái hấp thu photphat. Trong hạ photphat máu do thận, ống thận không có khả năng tái hấp thu đủ ion photphat, trong khi nồng độ photphat trong các dịch cơ thể giảm rất thấp. Tình trạng này thường không gây ra ngay những bất thường nghiêm trọng do nồng đồ photphat trong dịch ngoại bào có thể biến thiên trong một khoảng lớn mà không gây ra những rối loạn chức năng trong tế bào. Tuy nhiên, sau một thời gian dài, lượng photphat thấp sẽ làm giảm calci trong xương, dẫn đến còi xương. Thể còi xương này không đáp ứng với điều trị vitamin D, khác với các thể còi xương khác thường đáp ứng nhanh với điều trị vitamin D, như đã được thảo luận ở chương 80.
Nhiễm toan ống thận – Suy giảm chức năng ống thận trong tiết ion H+. Trong nhiễm toan ống thận, các ống thận không có khả năng bài tiết đủ lượng ion H+. Kết quả là, một lượng lớn Natri bicarbonat liên tục bị mất trong nước tiểu. Sự mất liên tục này gây ra tình trạng tiếp tục nhiễm toan chuyển hoá, như đã thảo luận ở chương 31. Đây là loại bất thường thận có thể sinh ra do bất thường di truyền, hoặc nó có thể xảy ra do kết quả của việc tổn thương rộng các ống thận.
Đái tháo nhạt—Suy giảm chức năng thận trong việc đáp ứng với Hormon chống bài niệu. Khi các ống thận không đáp ứng với hormon chống bài niệu có thể tạo ra một lượnglớn nước tiểu loãng đào thải ra bên ngoài. Nếu cơ thể được cung cấp nhiều nước, tình trạng này hiếm khi gây nguy hiểm cho bệnh nhân. Tuy nhiên, khi lượng nước được cung cấp không đủ, cơ thể sẽ nhanh chóng bị mất nước.
Hội chứng Fanconi—Thiếu hụt trong quá trình tái hấp thu tất cả các chất ở ống thận. Hội chứng Fanconi thường gắn liền với việc tăng bài tiết qua nước tiểu tất cả các chất bào gồm: amino acid, glucose, và phosphat. Trong trường hợp nặng, có thể gặp một số biểu hiện khác như (1) suy giảm khả năng tái hấp thu Natri bicarbonat, kết quả gây nhiễm toan chuyển hóa; (2) tăng bài tiết kali và đôi khi cả canxi; và (3) đái tháo nhạt.
Có nhiều nguyên nhân dẫn đến hội chứng Fanconi, dẫn đến kết quả là sự mất khả năng của tất cả các tế bào ống thận trong việc vận chuyển các chất khác nhau. Một số các nguyên nhân bao gồm (1) các khiếm khuyết di truyền trong cơ chế vận chuyển tế bào, (2) các chất độc hoặc các loại thuốc gây tổn thương các tế bào biểu mô ống thận, và (3) tổn thương các tế bào ống thận do thiếu máu cục bộ. Các tế bào ống lượn gần đặc biệt bị ảnh hưởng trong hội chứng Fanconi do tổn thương ống thận bởi vì đây là các tế bào đóng vai trò chính trong việc tái hấp thu và bài tiết ra các loại thuốc và độc tố.
Hội chứng Bartter—Giảm tái hấp thu Natri, clo và Kali ở quai Henle. Hội chứng Bartter là một rối loạn hiếm gặptrên gen lặn-NST thường gây suy giảm chức năng của hệ thống đồng vận chuyển 1Natri-2Clo-1Kali hoặc do sự thiếu hụt các kênh Kali trên theluminal membrane hoặc kênh Clo trên basolateral membrane ở đoạn phình nhánh lên quai Henle. Những rối loạn này dẫn đến tăng bài tiết nước, Natri, Clo, Kali và Calci qua thận. Mất muối và nước qua thận dẫn đến giảm nhẹ khối lượng tuần hoàn, kết quả là kích hoạt hệ thống reninangiotensinaldosterone. Việc tăng aldosteron và tăng tốc độ dòng chảy qua ống lượn xa là do thiếu hụt sự tái hấp thu ở quai Henle, điều này sẽ kích thíchtiết Kali và H+ ở ống góp, cuối cùng gây giảm Kali máu và nhiễm kiềm chuyển hóa.
Hội chứng Gitelman—Giảm tái hấp thu NaCl ở ống lượn xa. Hội chứng Gitelman là một rối loạn trên gen lặnNST thường trên kênh đồng vận chuyển Natri-Clo, nợi nhạy cảm thiazide ở ống lượn xa. Bệnh nhân có hội chứngGitelmam có một số đặc điểm như bệnh nhân mắc hội chứng Bartter- mất muối và nước, giảm nhẹ thể tích tuần hoàn, và kích hoạt hệ thống reninangiotensinaldosterone- mặc dù những bất thường này thường ít nghiêm trọng hơn ở bệnh nhân có hội chứng Gitelman.
Do các khuyết tật ở ống thận trong hội chứng Bartter và Gitelman là không thể sửa chữa, nên điều trị chủ yếu tập trung vào điều trị thay thế việc mất NaCl và Kali. Một số nghiên cứu cho rằng việc ức chế tổng hợp prostaglandin với thuốc chống viêm non-steroid và thuốc kháng aldosteron, như spironolactone, có thể có tác dụng trong việc điều chỉnh hạ Kali máu.
Hội chứng Liddle—Tăng tái hấp thu Natri.
Hội chứng Liddle là một rối loạn hiếm gặp nằm trên gen trộiNST thường do các đột biến khác nhau trên biểu mô kênh Natri (ENaC) – nơi nhạy cảm amiloride ở ống lượn xa và ống góp. Những đột biến này gây ra hoạt động quá mức của ENaC, dẫn đến tăng tái hấp thu Natri và nước, tăng huyết áp và nhiễm kiềm chuyển hóa, tương tự những biến đổi xảy ra khi tiết quá nhiều aldosterone(giai đoạn đầu trong chứng tăng aldosteron).
Tuy nhiên, ở bệnh nhân có hội chứng Liddle’s, việc giữ Natri sẽ làm giảm tiết renin và hệ thống angiotensin II, từ đó làm giảm bài tiết aldosterone ở tuyến thượng thận. May mắn, hội chứng Liddle có thể được điều trị với các thuốc lợi tiểu amiloride, chất ức chế hoạt động quá mức của ENaC.
Điều trị suy thận bằng ghép thận hoặc lọc máu với thận nhân tạo.
Mất chức năng thận nặng, cấp tính hoặc mạn tính, là một mối đe dọa đối với tính mạng , đòi hỏi phải loại bỏ các chất thải độc hại và khôi phục lại thể tích và thành phần bình thường của dịch cơ thể. Điều này có thể được giải quyết nhờ ghép thận hoặc lọc máu với thận nhân tạo. Khoảng 600,000 bệnh nhân ở Mỹ đang được điều trị bằng các phương phápthay thế thận.
Thành công của viêc ghép 1 thận của người cho cho một bệnh nhân ESRD là có thể phục hồi lại chức năng thận tới mức đủ để duy trì cân bằng nội môi của dịch và các chất điện giải ở ngưỡng bình thường tối thiểu. Khoảng 18,000 ca ghép thận được thực hiện mỗi năm ở Mỹ. Bệnh nhân được ghép thận thường sống lâu hơn và gặp ít các vấn đề sức khỏe hơn so với những người được duy trì chức năng thận bằng chạy thận nhân tạo. Việc duy trì ức chế miễn dịch được áp dụng nhằm ngăn chặn tình trạng thải ghép cấp tính và tổn thương thận ghép. Tác dụng phụ của việc dùng ức chế miễn dịch là làm tăng nguy cơ nhiễm khuẩn và tăng nguy cơ mắc một số bệnh ung thư, tuy nhiên liều ức chế miễn dịch sử dụng có thể được giảm dần qua thời gian nhằm giảm các nguy cơ trên.
Khoảng 400,000 người Mỹ bị suy thận không hồi phục hoặc cắt thận toàn bộ đang được duy trì bằng lọc máu với thận nhân tạo. Lọc máu có thể được sử dụng trong một số thể tổn thương thận cấp nhằm hỗ trợ bệnh nhân cho đến khi chức năng thận trở lại bình thường. Trong trường hợp mất chức năng thận không hồi phục, cần thiết phải lọc máu chu kì để duy trì sự sống. Do lọc máu không thể duy trì hoàn toàn bình thường các thành phần dịch cơ thể và không thể thay thế hoàn toàn các chức năng phức tạp của thận, sức khỏe của bệnh nhân vẫn bị suy giảm đáng kể.
Nguyên tắc cơ bản của lọc máu
Nguyên tắc cơ bản của thận nhân tạo là đưa máu vào ống dẫn được giới hạn bằng một màng mỏng trong một phút. Ở phía bên kia của màng là dịch thẩm tách, nơi các chất không cần thiết trong máu sẽ thoát ra theo cơ chế khuếch tán.
Sơ đồ 32-8 cho thấy các thành phần cấu tạo của một loại thận nhân tạo, trong đó máu chảy liên tục giữa 2 màng mỏng bằng cellophane, bên ngoài màng là dịch thẩm tách. Màng cellophane là màng bán thấm cho phép các thành phần của huyết tương đi qua, ngoại trừ protein huyết tương, khuếch tán theo cả 2 hướng – từ huyết tương ra dịch thẩm tách và từ dịch thẩm tách trở lại huyết tương. Nếu nồng độ các chất ở trong huyết tương lớn hơn so với dịch thẩm tách, sẽ có một lưới vận chuyển các chất từ huyết tương vào trong dịch thẩm tách.
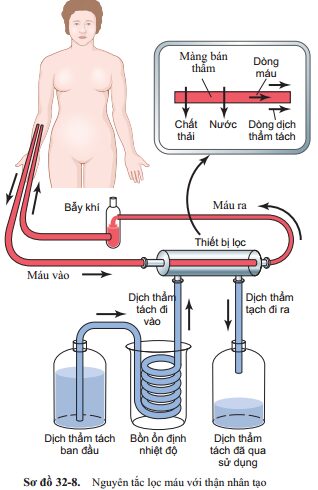
Tốc độ vận chuyển các chất tan qua màng phụ thuộc vào (1) gradient nồng độ của chất tan giữa 2 bên màng,(2) tính thấm của màng với chất tan, (3) diện tích bề mặt của màng, và (4) thời gian máu và dịch tiếp xúc với nhau qua màng.
Do đó, tốc độ vận chuyển của các chất tan đạt lớn nhất vào thời điểm ban đầu, khi mà gradient nồng độ đạt cao nhất (khi bắt đầu quá trình lọc máu) vàc chậm lại khi gradient nồng độ giảm.
Trong hệ thống lọc, với trường hợp này là “chạy thận nhân tạo”, máu và dịch thẩm tách chảy trong thận nhân tạo, sự khuếch tán theo gradient nồng độ có thể giảm xuống và sự vận chuyển chất tan qua màng có thể được tối ưu hóa bằng cách tăng tốc độ dòng chảy của máu, của dịch thẩm tách, hoặc cả hai.
Trong hoạt động bình thường của thận nhân tạo, máu chảy lại về tĩnh mạch liên tục hoặc không liên tục. Tổng lượng máu chứa trong thận nhân tạo ở bất kỳ thời điểm nào đều nhỏ hơn 500 ml, tốc độ dòng chảy có thể lên tới hàng trăm ml một phút, và tổng diện tích bề mặt khuếch tán là từ 0,6 đến 2,5 mét vuông. Để tránhhiện tượng đông máu trong thận nhân tạo, một lượng nhỏ heparin được đưa vào máu khi máu bắt đầu vào thận nhân tạo. Ngoài việc khuếch tán của các chất tan, có thể tăng lượng vận chuyển nước và các chất tan bằng cách thêm dịch làm tăng áp lực thủy tĩnh và đẩy các chất tan qua màng của thiết bị lọc; quá trình lọc như vậy được gọi là siêu lọc.
Dịch thẩm tách
Bảng 32-7 so sánh thành phần của dịch thẩm tách điển hình với huyết tương bình thường và huyết tương của bệnh nhân bị ure huyết. Nhận thấy rằng, nồng độ các ion và các chất khác trong dịch thẩm tách không giống với nồng độ các chất đó trong huyết tương và huyết tương bệnh ure huyết.Để thay thế thận, chúng được điều chỉnh ở mức thích hợp nhằm đảm bảo tạo ra sự vận chuyển qua lại của nước và các chất hòa tan qua màng trong suốt quá trình lọc.
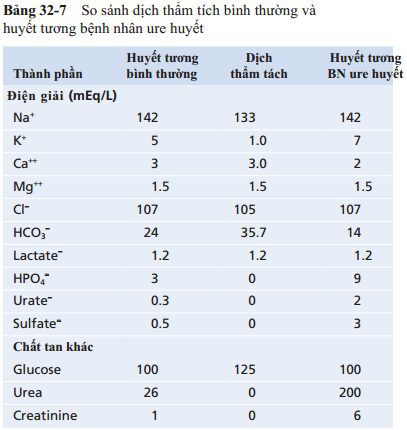
Lưu ý rằng không có phosphat, ure, urat, sulfat, haycreatinin trong dịch thẩm tách; tuy nhiên, những chất tan này hiện diện với nồng độ cao trong máu của các trường hợp bị nhiễm ure huyết. Vì vậy, khi một bệnh nhân có hội chứng ure huyết phải lọc máu, các chất này sẽ mất đi một lượng lớn vào trong dịch thẩm tách.
Hiệu quả của thận nhân tạo được thể hiện qua lượng huyết tương được làm sạch các chất tan mỗi phút, điều này đã được thảo luận ở chương 28, đây là thông số cơ bản để đánh giá hiệu quả chức năng thận trong việc đào thải các chất không mong muốn khỏi cơ thể. Hầu hết thận nhân tạo có thể làm sạch ure từ huyết tương vơí tốc độ 100-225 ml/min, điều này cho thấy tốc độ ít nhất để thải trừ ure, thận nhân tạo có thể hoạt động với tốc độ nhanh gấp đôi 2 thận bình thường cùng làm việc – độ thanh thải ure chỉ 70ml/min. Thận nhân tạo thường được sử dụng 4-6 giờ mỗi ngày, 3 lần 1 tuần. Vì vậy, độ thanh thải toàn bộ huyết tương sẽ bị giới hạn rõ thì thay thận nhân tạo bằng thận bình thường. Tuy nhiên, nên nhớ rằng thận nhân tạo không thể thay thế được các chức năng khác của thận, ví dụ như tiết erythropoietin, chất cần thiết cho quá trình sản sinh hồng cầu.
Bài viết được dịch từ sách: Guyton and Hall text book of Medicine and Physiology
 Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.
Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.