CHƯƠNG 31
THĂNG BẰNG KIỀM TOAN
Sự dịch chuyển của ion hydro (H+): sự cân bằng cũng tương tự như một số ion khác trong cơ thể ví dụ như: phải có sự cân bằng giữa lượng ion H+ được tạo ra và ion H+ thải loại từ cơ thể để đảm bảo cân bằng kiềm toan. Giống như các ion khác, thận là cơ quan đóng vai trò quan trọng trong việc điều hòa việc loại bỏ ion H+ ra khỏi có thể. Tuy nhiên việc điều chỉnh lượng ion H+ trong dịch ngoại bào nhiều hơn lượng ion H+ được đào thải bởi thận. Nhiều cơ chế đệm acid-base là máu, tế bào, và phổi cũng rất cần thiết trong duy trì nồng độ bình thường của ion H+ trong cả dịch ngoại bào và nội bào.
Trong chương này chúng ta sẽ xem xét các cơ chế khác nhau điều hòa nồng độ ion H+ và đặc biệt chú trọng kiểm sóat lượng ion H+ mà thận bài tiết ra và tái hấp thu, sự sản xuất và bài tiết của ion bicarbonate (HCO3-). Môt trong những thành phần quan trọng của hệ thống đệm acid-base trong dịch cơ thể.
CÁC YẾU TỐ CHÍNH ẢNH HƯỞNG ĐẾN NỒNG ĐỘ H+ TRONG CƠ THỂ
Nồng độ H+ được quyết định bởi sự hoạt động của hầu hết các loại enzyme trong cơ thể. Do đó những thay đổi trong nồng độ H+ thể hiện hoạt động chức năng của tế bào và cơ quan trong cơ thể.
So với các ion khác, nồng độ ion H+ của các chất dịch trong cơ thể bình thường luôn được giữu ở mức thấp. Ví dụ: nồng độ ion Na+ trong dịch ngoại bào (142mEq/L) lớn hơn khoảng 3,5triệu lần nồng độ bình thường của ion H+( chỉ số trung bình là 0.00004mEq/L). Quan trong không kém, sự thay đổi của nồng độ ion H+ bình thường trong dịch ngoại bào khoảng 1000000 triệu thì nồng độ ion Na+ bình thường mới bị biến đổi. Như vậy, độ chính xác của ion H+ là rất cao và nó có vai trò quan trọng đến các chức năng của tế bào.
ĐỊNH NGHĨA VÀ Ý NGHĨA CỦA ACID-BASE
Ion H+ là một proton tự do duy nhất có nguồn gốc từ môt nguyên tử hydro. Các phân tử có chứa các nguyên tử hydro có thể giải phóng các ion H+ sau các phản ứng sinh hóa ví dụ như acid. Ví dụ acid hydrochloric (HCl) khi hòa tan trong nước sẽ tạo thành 2 ion là H+ và Cl-. Tương tự như vậy, acid carbonic (H2CO3) ion hóa trong nước để tạo thành H+ và HCO3-.
Một base là một ion hoặc một phân tử có thể nhận 1 ion H+. Ví dụ như HCO3- là một ion base vì nó có thể kết hợp với ion H+ để tạo thành H2CO3. Tương tự HPO4- là một base vì nó có thể nhận 1 H+ để tạo thành H2PO4-. Các protein cơ thể cũng có chức năng như base vì một số acid amin tạo nên protein có điện tích âm có khả năng nhận H+. Các hemoglobin của tế bào máu và các protein trong các tế bào khác của cơ thể là những base quan trọng nhất của cơ thể.
Thuật ngữ base và kiềm là 2 từ đồng nghĩa. Chất kiềm là một phân tử được hình thành bởi sự kết hợp của một hoặc nhiều phân tử kiềm như Na, K, Li, v.v… với một ion base ví dụ ion OH-. Các base phản ứng nhanh với các ion H+ để nhanh chóng lập lại cân bằng nội môi. Tương tự, các chất kiềm phản ứng trong cơ thể loại bỏ các ion H+ dư thừa trong dịch cơ thể, chống lại việc sản xuất ra nhiều H+, trong đó có tình trạng nhiễm toan.
Căn cứ xác định acid mạnh-yếu. Một acid mạnh là một chất nhanh chóng phân ly thành một lượng lớn ion H+ trong dung dịch. Ví dụ HCl. Acid yếu ít có khả năng phân ly ra ion H+ vì khả năng hoạt động yếu. Ví dụ H2CO3. Một base mạnh là một chất phản ứng nhanh và mạnh với H+ và nhanh chóng loại bỏ ion H+ ra khỏi dung dịch. Ví dụ OH- phản ứng với H+ để tạo thành H2O. Một base yếu điểm hình là HCO3- vì nó phản ứng với H+ mạnh hơn với OH-. Hầu hết các acid và base trong dịch ngoại bào đều là các acid yếu và base yếu. Trong bài này chúng ta tìm hiểu về 2 chất quan trọng nhất là acid carbonic H2CO3 và ion HCO3-.
Nồng độ ion H+ bình thường, sự thay đổi pH của cơ thể khi bị nhiễm toan và nhiễm kiềm. Nồng độ H+ trong máu thường được kiểm soát rất chặt chẽ và duy trì quanh một giá trị trung bình khoảng 0.00004 mEq/L (40 nEq/l). Biến đổi bình thường khoảng 3-5 nEq/L nhưng trong các điều kiện khắc nghiệt thì nồng độ ion H+ có thể nằm trong khoảng 10-160 nEq/L mà không gây ra cái chết.
Bởi nồng độ H+ bình thường là rất thấp và các số quá nhỏ nên người ta biểu thị pH thành các số theo hàm logarit. Mối liên hệ giữa nồng độ ion H+ và pH của cơ thể được thể hiện qua công thức sau: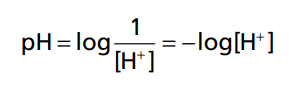
Ví dụ bình thường nồng độ H+ là 40nEq/L (0.00000004 Eq/L). Vậy pH bình thường là:
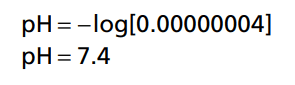
Từ công thức này có thể thấy pH tỷ lệ nghịch với nồng độ H+, do đó khi nồng độ H+ cao thì pH nhỏ và khi nồng độ H+ thấp thì pH lớn.
Độ pH bình thường của máu động mạch là 7.4 trong khi pH máu tĩnh mạch và dịch kẽ là 7.35 bởi lường carbon dioxid (CO2) sinh ra từ các mô vào hòa tan trong dung dịch tạo thành H2CO3 (Bảng 31-1). Vì bình thường độ pH máu động mạch là 7.4, một người được coi là bị nhiễm toan khi độ pH giảm xuống dưới mức 7.4 và coi là nhiễm kiềm khi độ pH tăng trên 7.4. Giới hạn dưới của độ pH mà ở đó con người có thể tồn tại được khoảng vài giờ là 6.8 và giới hạn trên của độ pH là khoảng 8.0.
pH nội bào thường thấp hơn so với pH huyết tương vì sự trao đổi chất trong tế bào sẽ tạo ra các acid đặc biệt là acid H2CO3. Độ pH của dịch nội bào được ước tính khoảng 6.0-7.4. Thiếu O2 mô và máu lưu thông kém đến các mô có thể gây ra sự tích tụ acid và gây giảm pH nội bào. Độ pH nước tiểu có thể dao động trong khoảng 4.5-8.0 tùy thuộc tình trạng cân bằng acid-base của dịch ngoại bào. Như đã biết, thận đóng vai trò quan trọng trong việc điều hòa nồng độ H+ nhờ quá trình bài tiết acid hay base ở ống thận.
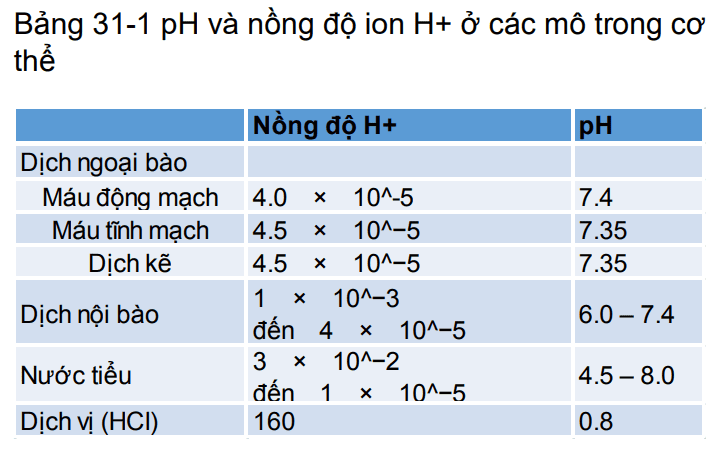
Bảng 31-1
Ví dụ điển hình của dịch trong cơ thể có tính acid là dịch vị dạ dày HCl (được tiết ra từ tế bào thành của dạ dày), sẽ được nhắc đến kĩ hơn ở chương 65. Nồng độ H+ trong các tế bào thành gấp khoảng 4 triệu lần so với nồng độ ion H+ trong máu (pH = 0.8). Trong phần còn lại của chương này sẽ tập trung tới quá trình điều hòa nồng độ ion H+ trong dịch ngoại bào.
CƠ CHẾ ĐIỀU HÒA NỒNG ĐỘ H+: HỆ THỐNG ĐỆM, PHỔI, THẬN
Ba hệ thống chính điều hòa nồng độ H+ của các chất dịch trong cơ thể ngăn ngừa sự nhiễm toan hoặc nhiễm kiềm: (1) hệ thống đệm acid-base trong các dịch cơ thể, ở đó các chất đệm sẽ kết hợp ngay với 1 acid hoặc một base để ngăn chặn sự thay đổi quá lớn nồng độ H+; (2) cơ quan hô hấp là nơi đào thải CO2 từ dịch ngoại bào ra khỏi cơ thế ( H2CO3).; (3) thận, cơ quan bài tiết acid hoặc kiềm qua nước tiểu nhờ đó điều hòa nồng độ H+ trong dịch cơ thể trong mức độ bình thường, không nhiễm toan hoặc nhiễm kiềm.
Khi có sự thay đổi nồng độ H+, các hệ thống đệm trong dịch cơ thể sẽ phản ứng ngay trong vòng vài giây để giảm thiểu sự thay đổi này. Hệ thống đệm không thể loại bỏ H+ hoặc thêm H+ cho cơ thể nhưng nó có khả năng gắn với các acid hoặc base để tái lập trạng thái cân bằng của cơ thể.
Cơ chế điều hòa thứ hai là hệ thống hô hấp, nó sẽ hoạt động trong vòng vài phút để loại bỏ CO2 và qua đó loại bỏ H2CO3 ra khỏi cơ thể. Hai cơ chế đầu tiên giữ cho nồng độ H+ không biến đổi quá nhiều cho đến khi cơ chế thứ 3 được khởi động đó là thận. Thận loại bỏ acid hoặc base dư thừa ra khỏi cơ thể. Mặc dù đáp ứng ở thận là tương đối chậm so với các cơ chế điều hòa khác, trong 1 giờ đến vài ngày, nhưng đấy là cơ chế điều hòa mạnh nhất trong các cơ chế điều hòa cân bằng acid-base trong cơ thể.
CÁC HỆ THỐNG ĐÊM H+ TRONG DỊCH CƠ THỂ
Bất kì một hệ thống đệm nào khi phản ứng với H+ cũng có tính thuận nghịch. Dạng tổng quát của phản ứng đệm:
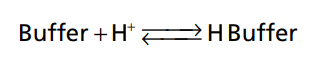
Ví dụ, 1H+ tự do kết hợp với một chất đệm để tạo thành một acid yếu (đệm H) sau đó acid này vẫn có khả năng phân ly để giải phòng ra H+ và chất đệm ban đầu. Khi nồng độ H+ tăng lên thì cân bằng của phản ứng dịch chuyển sang phải và có ngày càng nhiều H+ được liên kết với hệ thống đệm miễn là chất đệm luôn có sẵn. Ngược lại, khi nồng độ H+ giảm, phản ứng dịch chuyển sang trái và H+ được giải phóng từ hệ thống đệm. Bằng cơ chế này, nồng độ H+ trong dịch cơ thể luôn giữ ở mức ổn định.
Tầm quan trọng của hệ thống đệm được thể hiện rõ khi nồng độ H+ thấp trong các dịch cơ thể và lượng tương đối lớn acid được sản xuất ra trong cơ thể. Ví dụ 80 mEq ion H+ được đưa vào cơ thể qua thức ăn hoặc được cơ thể sản xuất ra trong quá trính troa đổi chất. Trong khi nồng độ bình thường chỉ khoảng 0.00004 mEq/L nếu như không có hệ thống đệm thì việc tiêu hóa thức ăn hàng ngày và acid sinh ra trong quá trình trao đổi chất sẽ gây ra sự thay đổi lớn nồng độ H+ trong cơ thể. Hệ thống đệm quan trọng nhất trong dịch cơ thể là hệ thống đệm bicarbonate.
HỆ THỐNG ĐỆM BICARBONATE
Hệ thống bicarbonate đệm bao gồm hai thành phần: (1) một axit yếu, H2CO3, và (2) một muối bicarbonate, chẳng hạn như natri bicarbonate (NaHCO3). H2CO3 được hình thành trong cơ thể bằng phản ứng của CO2 với H2O.
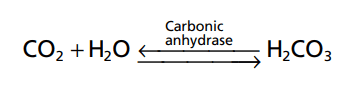
Phản ứng này chậm, và 1 phần cực nhỏ của H2CO3 được hình thành, trừ khi có thêm enzym anhydrase carbonic. Enzyme này là đặc biệt phong phú trong thành phế nang phổi, nơi CO2 được phát hành; anhydrase cũng có mặt trong các tế bào biểu mô của thận ống, nơi CO2 phản ứng với H2O tạo thành H2CO3. H2CO3 ion hóa yếu để tạo thành một lượng nhỏ H + và HCO3-.
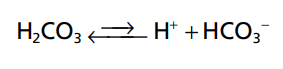
Hợp phần thứ hai của hệ thống, muối bicarbonate, chủ yếu là NaHCO3 trong ngoại bào chất lỏng. NaHCO3 ion hóa gần như hoàn toàn để tạo thành HCO3- và Na+, như sau:

Bây giờ, đưa toàn bộ hệ thống với nhau, chúng ta có tiếp theo:
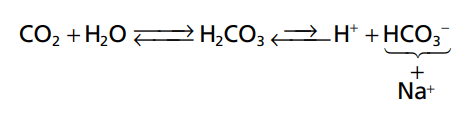
Bởi vì H2CO3 phân ly yếu H2CO3, H + tập trung là cực kỳ nhỏ. Khi một axit mạnh như HCl được thêm vào dung dịch đệm bicarbonate, lượng H + tăng lên từ phân li axit (HCl → H + + Cl-) được đệm bởi HCO3
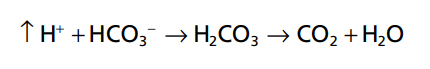
Kết quả là, nhiều H2CO3 hơn được hình thành, gây tăng CO2 và H2O. Từ những phản ứng này, ta có thể thấy rằng H+ từ axit mạnh HCl phản ứng với HCO3 – tạo thành H2CO3 axit rất yếu, do đó bị phân huỷ tạo thành CO2 và H2O. CO2 dư thừa rất nhiều dẫn tới kích thích hô hấp, trong đó loại bỏ CO2 từ dịch ngoại bào.
Các phản ứng ngược lại diễn ra khi một base mạnh, chẳng hạn như natri hydroxide (NaOH), được thêm vào bicarbonate dung dịch đệm.
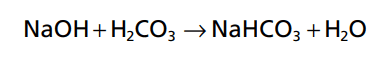
Trong trường hợp này, OH- từ NaOH kết hợp với H2CO3 để tạo thêm HCO3- . Do đó, base yếu NaHCO3 thay thế bằng base mạnh NaOH. Đồng thời, nồng độ của H2CO3 giảm (vì nó phản ứng với NaOH), gây ra nhiều khí CO 2 để kết hợp với H2O để thay thế H2CO3. Do đó, kết quả là CO2 nồng độ trong máu giảm, nhưng lượng CO2 giảm trong máu ức chế hô hấp và giảm tốc độ của CO2 thở ra. Sự gia tăng HCO3- trong máu xảy ra là bù lại bằng sự gia tăng bài tiết HCO3 – qua thận.
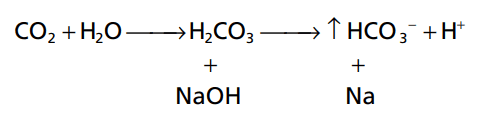
ĐỊNH LƯỢNG ĐỘNG NĂNG CỦA HỆ ĐÊM BICARBONATE
Tất cả các loại axit, kể cả H2CO3, được ion hóa một mức độ nào. Từ cân nhắc cân bằng khối lượng, nồng độ của H + và HCO3 – tỷ lệ thuận với nồng độ của H2CO3.
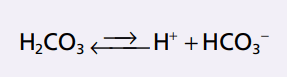
Đối với axit bất kỳ, nồng độ tương đối axit của nó ion phân ly được xác định bởi sự hằng số phân ly K
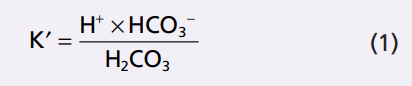
Phương trình này chỉ ra rằng trong một dung dịch H2CO3, các lượng H + tự do bằng
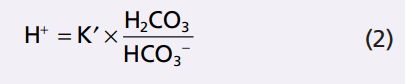
Nồng độ của H2CO3 không phân ly không thể đo bằng dung dịch bởi vì nó nhanh chóng phân ly thành CO2 và H2O hoặc H + và HCO3-. Tuy nhiên, lượng CO2 hòa tan trong máu là tỷ lệ thuận với số lượng của H2CO3 không phân ly. Do đó, phương trình 2 có thể được viết lại như sau
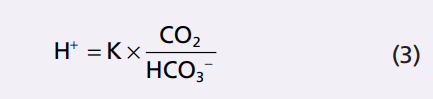
Hằng số phân ly (K) cho phương trình (3) chỉ là khoảng 1/400 của hằng số phân ly (K ‘) của phương trình 2 vì tỷ lệ tương xứng giữa H2CO3 và CO2 là 1: 400.
Phương trình 3 được viết về tổng số CO2 hòa tan trong dung dịch. Tuy nhiên, hầu hết các thử nghiệm lâm sàng đo lường áp lực CO2 máu (pCO2) lớn hơn lượng CO2 thực tế. Tuy nhiên, lượng CO2 trong máu là một hàm tuyến tính của pCO2 nhân với hệ số khả năng hòa tan CO2, ở điều kiện sinh lý hệ số hòa tan CO2 là 0,03 mmol / mm Hg ở nhiệt độ cơ thể. Điều này có nghĩa là 0.03 mmol của H2CO3 là hiện diện trong máu cho mỗi mmHg PCO2 đo được. Do đó, phương trình 3 có thể được viết lại như sau
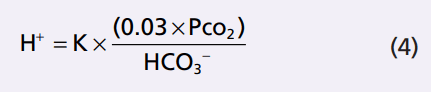
Cân bằng Henderson-Hasselbalch. Như đã thảo luận trước đó, lượng H+ thể hiện bởi độ pH chứ không phải nồng độ H+ thực tế. Nhớ lại độ pH là định nghĩa là pH = -log [H +]
Hằng số phân ly (pK) có thể được thể hiện trong một cách thức tương tự.
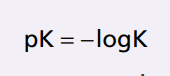
Do đó, chúng ta có thể biểu thị lượng H + ở cân bằng (4) trong các đơn vị pH bằng cách lấy logarit của phương trình, trong đó
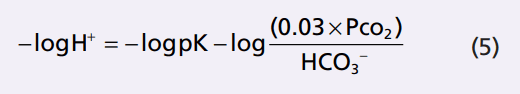
Vì thế,
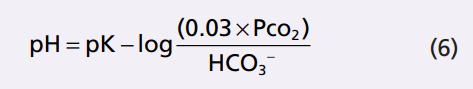
Thay vì làm việc với một logarit âm, chúng ta có thể thay đổi các dấu hiệu của lôgarit và đảo ngược tử số và mẫu số , ta được
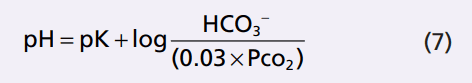
Đối với hệ thống đệm bicarbonate, các pK là 6,1, và (7) có thể được viết như
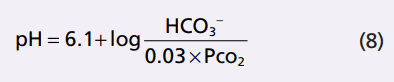
Phương trình (8) là phương trình Henderson-Hasselbalch, và với nó, người ta có thể tính toán pH của dung dịch nếu biết nồng độ mol của HCO3- và pCO2. Từ phương trình Henderson-Hasselbalch, ta thấy sự gia tăng HCO3- làm cho độ pH tăng, chuyển dịch cân bằng acid-base đối với nhiễm kiềm. Sự tăng pCO2 làm cho pH giảm, chuyển cân bằng acid-base đối với nhiễm toan.
Các phương trình Henderson-Hasselbalch, ngoài xác định các yếu tố quyết định điều chỉnh độ pH bình thường và cân bằng acid-base trong dịch ngoại bào, cung cấp cái nhìn sâu sắc về sự kiểm soát sinh lý của thành phần acid và base của dịch ngoại bào. Như đã thảo luận, nồng độ HCO3- được điều tiết chủ yếu qua thận, trong khi các pCO2 trong dịch ngoại bào được điều khiển bởi hô hấp. Bằng cách tăng tỷ lệ hô hấp, phổi loại bỏ CO2 khỏi huyết tương, và bằng cách giảm hô hấp, phổi nâng pCO2. Sinh lý bình thường kết quả cân bằng acid-base là sự phối hợp của cả hai cơ quan phổi và thận, và các rối loạn acid-base xảy ra khi một hoặc cả hai cơ chế kiểm soát được suy yếu, làm thay đổi hoặc là HCO3- hoặc pCO2 của dịch ngoại bào.
Khi rối loạn cân bằng acid-base từ thay đổi HCO3- dịch ngoại bào, chúng được gọi rối loạn acid-base chuyển hoá. Do đó, toan do giảm HCO3- được gọi là nhiễm toan chuyển hóa, trong khi nhiễm kiềm do gia tăng HCO3- được gọi là nhiễm kiềm chuyển hóa. Toan gây ra bởi một tăng pCO2 được gọi là nhiễm toan hô hấp, trong khi nhiễm kiềm do giảm pCO2 được gọi là nhiễm kiềm hô hấp
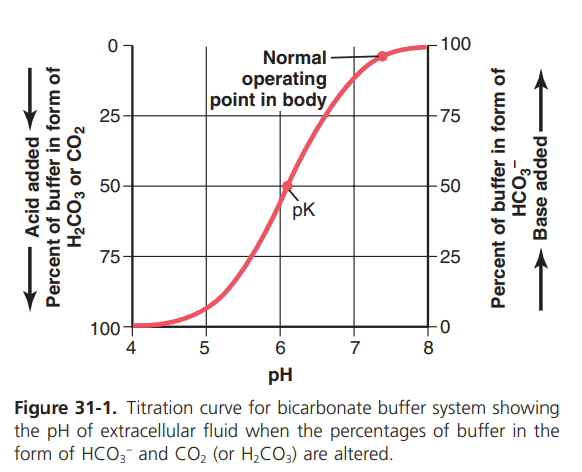
Hình 31-1
Đường cong chuẩn độ hệ đệm Bicarbonat. Hình 31-1 cho thấy những thay đổi pH của dịch ngoại bào khi tỷ lệ của HCO3- và CO2 trong dịch ngoại bào thay đổi. Khi nồng độ của hai thành phần này bằng nhau, phần bên phải của phương trình (8) trở thành log của 1, bằng 0. Do đó, khi hai các thành phần của hệ thống đệm bằng nhau, độ pH của dung dịch bằng pK (6.1) của bicarbonate hệ thống đệm. Khi base được thêm vào hệ thống, một phần của CO2 hòa tan được chuyển đổi thành HCO3-, gây ra tăng tỷ lệ của HCO3-/CO2 và tăng pH, từ phương trình Henderson-Hasselbalch. Khi axit được thêm vào, nó được đệm bởi HCO3-, trong đó sau đó được chuyển đổi thành CO2 hòa tan, giảm tỷ lệ HCO3-/CO2 và giảm độ pH của dịch ngoại bào.
“Đệm điện” xác định bằng lƣợng và nồng độ tương đối của các thành phần đệm. Từ đường cong chuẩn độ trong hình 31-1, ta thấy một số điểm rõ ràng. Đầu tiên, độ pH của hệ thống là giống như pK khi từng thành phần (HCO3- và CO2) tạo thành 50% của tổng nồng độ của hệ thống đệm. Thứ hai, hệ thống đệm là hiệu quả nhất trong các trung tâm một phần của đường cong, nơi mà độ pH gần pK của hệ thống. Hiện tượng này có nghĩa là thay đổi độ pH cho bất kỳ lượng nhất định của axit hoặc base bổ sung vào hệ thống là nhất là khi độ pH gần pK của hệ thống. Bộ đệm hệ thống vẫn còn hiệu quả khi để đơn vị 1.0 pH ở hai bên của pK, mà đối với các hệ thống đệm bicarbonate kéo dài từ một độ pH khoảng 5,1-7,1 đơn vị. ngoài khoảng giới hạn, đệm điện nhanh chóng giảm. Và khi tất cả lượng CO2 đã được chuyển đổi thành HCO3- hoặc khi tất cả các HCO3- đã được chuyển đổi thành CO2, hệ thống không có đệm điện.
Nồng độ tuyệt đối của các bộ đệm cũng là một là yếu tố quan trọng trong việc xác định độ mạnh của một bộ đệm hệ thống. Với nồng độ thấp của các bộ đệm, chỉ có một nhỏ lượng axit hoặc base bổ sung vào dung dịch làm thay đổi pH đáng kể.
Đệm bicarbonate là quan trọng nhất trong các bộ đệm của dịch ngoại bào. Từ đường cong chuẩn độ thể hiện trong Hình 31-1, người ta sẽ không mong đợi bộ đệm bicarbonate mạnh vì hai lý do: Thứ nhất, độ pH của dịch ngoại bào là khoảng 7,4, trong khi pK của hệ thống đệm bicarbonate là 6,1, có nghĩa là có là khoảng 20 lần so với đệm bicarbonate. Vì lý do này, hệ thống này hoạt động dựa trên phần của đường cong đệm nơi độ dốc thấp và điện đệm là thấp. Thứ hai, nồng độ của các hai yếu tố của hệ thống bicarbonate, CO2 và HCO3 -, là không lớn.
Mặc dù có những đặc điểm trên, hệ đệm bicarbonate hệ thống là bộ đệm ngoại bào mạnh nhất trong cơ thể. Nghịch lý này là do thực tế hai yếu tố của hệ thống đệm, HCO3 – và CO2, được điều chỉnh tương ứng, bởi thận và phổi. Như một kết quả của các quy định này, độ pH của dịch ngoại bào có thể được kiểm soát chính xác bởi các tỷ lệ bổ sung của HCO3 – bằng thận và tỷ lệ loại bỏ CO2 bằng phổi.
HỆ THỐNG ĐỆM PHOSPHAT
Mặc dù hệ thống đệm phosphat không quan trọng như một hệ đệm dịch ngoại bào, nó đóng một vai trò quan trọng trong dịch đệm ở ống thận và các dịch bên trong tế bào.
Các yếu tố chính của hệ thống đệm phosphate là H2PO4- và HPO4 2- . Khi một axit mạnh như HCl được thêm vào một hỗn hợp của hai chất này, các hydro được chấp nhận bởi các base HPO4 2- và chuyển đổi để thành H2PO4 –
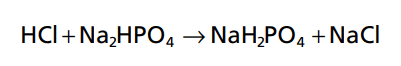
Kết quả của phản ứng này là các axit mạnh HCl, được thay thế bằng một axit yếu, NaH2PO4, và độ pH được giảm thiểu. Khi một base mạnh, chẳng hạn như NaOH, được thêm vào hệ thống đệm, OH được đệm bởi H2PO4- hình thành HPO4 + H2O.
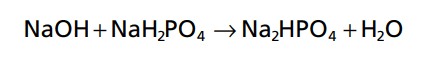
Trong trường hợp này, một base mạnh, NaOH, đang được thay thế bằng một base yếu, Na2HPO4, chỉ làm pH tăng nhẹ.
Hệ thống đệm phosphat có pK của 6.8, giá trị đó không xa pH bình thường trong dịch cơ thể là 7,4; điều này cho phép hệ thống đệm hoạt động gần tối đa . Tuy nhiên, nồng độ của nó trong dịch ngoại bào là thấp, chỉ khoảng 8% của bộ đệm bicarbonate. Do đó, tổng số đệm điện của hệ thống phosphate trong dịch ngoại bào là ít hơn nhiều so với đệm bicarbonate hệ thống.
Ngược lại với vai trò nhỏ của nó như là một bộ đệm ngoại bào, bộ đệm phosphate đặc biệt quan trọng trong việc hình ống dịch tiết của thận vì hai lý do: (1) phosphate thường trở nên tập trung rất nhiều ở ống thận, do đó tăng sức mạnh đệm của hệ thống phosphate, và (2) các dịch trong ống thường có pH thấp hơn một cách đáng kể so với pH dịch ngoại bào làm pH bộ đệm gần với pK (6.8) của hệ thống.
Hệ thống đệm phosphat cũng quan trọng trong bộ đệm dịch nội bào vì nồng độ phosphate trong dịch này là nhiều hơn so với các dịch ngoại bào. Ngoài ra, độ pH của dịch trong tế bào thấp hơn của dịch ngoại bào và do đó thường là gần hơn với các pK của hệ đệm phosphat so với dịch ngoại bào.
PROTEIN ĐÓNG VAI TRÒ QUAN TRỌNG TRONG HỆ ĐỆM NỘI BÀO
Protein là một trong những hệ đệm phong phú nhất trong cơ thể vì có nồng độ cao đặc biệt ở nội bào.
pH trong tế bào, dù thường thấp hơn so với dịch ngoại bào nhưng có sự thay đổi gần như tương ứng với sự thay đổi pH của dịch ngoại bào. H+ và HCO3- khếch tán nhẹ qua màng tế bào mặc dù những ion này phải mất một vài giờ để đạt được trạng thái cân bằng với dịch ngoại bào (ngoại trừ sự cân bằng được thiết lập nhanh chóng ở các tế bào hồng cầu). Tuy nhiên CO2 có thể khuếch tán nhanh chóng qua màng tế bào. Sự khuếch tán qua màng tế bào của các yếu tố của hệ đệm bicacbonat là nguyên nhân của hiện tượng pH nội bào thay đổi theo sự thay đổi của pH ngoại bào. Vì lí do này, các hệ đệm trong tế bào có thể giúp ngặn chặn sự thay đổi pH ngoại bào nhưng phải mất vài giờ mới có thể đạt được hiệu quả tối đa.
Trong tế bào hồng cầu, hemoglobin là một hệ đệm quan trọng
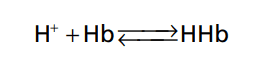
Khoảng 60-70% các hệ đệm hóa học của dịch cơ thể nằm trong tế bào, và hầu hết các kết quả này đến từ protein nội bào. Tuy nhiên, ngoại trừ hồng cầu, sự vận chuyển chậm của H+ và HCO3- khiến cho thường mất vài giờ mới đạt được khả năng đệm tối đa của protein nội bào trong trường hợp mất cân bằng kiềm toan ngoại bào.
Ngoài nồng độ cao trong tế bào, một yếu tố khác góp phần vào khả năng đệm của protein là pKs của nhiều hệ thống protein khá gần với pH nội bào.
Nguyên tắc isohydric: Mục đích của tất cả hệ đêm là thiết lập cân bằng với nồng độ H+
Chúng ta đã thảo luận về các hệ đệm một cách riêng rẽ trong dịch cơ thể. Nhưng trong thực tế tất cả các hệ đệm đều hoạt động cùng nhau vì H+ thường xuất hiện trong các phản ứng của các hệ đệm. Vì vậy, bất cứ khi nào thay đổi nồng độ H+ ngoại bào đều thay đổi sự cân bằng của các hệ đệm cùng lúc. Hiện tượng này được gọi là nguyên tắc isohydric, và được minh họa bằng công thức:
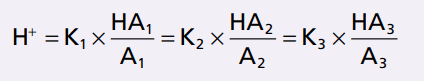
K1, K2, K3 là hằng số phân ly của 3 axit tương ứng, HA1, HA2, HA3 và A1, A2, A3 là nồng độ của các ion âm tự do cơ sở của 3 hệ thống đệm.
Ý nghĩa của nguyên tắc này là bất kì yếu tố nào làm thay đổi cân bằng của một trong các hệ thống đệm cũng làm thay đổi sự cân bằng của các hệ đệm khác vì các hệ đệm trao đổi H+ với nhau
CƠ CHẾ BÙ HÔ HẤP TRONG CÂN BẰNG ACID-BASE
Phương pháp thứ 2 để điều chỉnh rối lạn kiềm toan là điều chỉnh nồng độ CO2 ngoại bào nhờ phổi. Sự tăng thông khí giúp làm giảm CO2 ngoại bào, qua đó là giảm nồng độ H+. Ngược lại, giảm thông khí làm tăng CO2 ngoại bào dẫn đến tăng nồng độ H+
PHỔI THẢI RA CO2 GIÚP CÂN BẰNG QUÁ TRÌNH TRAO ĐỔI CO2
CO2 được hình thành liên tục trong cơ thể do quá trình trao đổi chất nội bào. Sau khi được hình thành, nó khuếch tán từ tế bào vào dịch kẽ, máu và dòng máu vận chuyển CO2 đến phổi, nơi nó được khuếch tán và các phế nang và ra ngoài nhờ hoạt động trao đổi khí của phổi. Thường khoảng 1.2 mol/L CO2 được hòa tan trong dịch ngoại bào, tương ứng với pCO2 tầm 40mmHg
Nếu tốc độ chuyển hóa hình thành CO2 tăng, pCO2 cũng tăng theo. Tương tự nếu chuyển hóa giảm, pCO2 cũng giảm. Nếu tỷ lệ thông khí phổi tăng lên, CO2 được thải ra ngoài nhiều và pCO2 trong giảm dịch ngoại bào. Do đó, những thay đổi trong thông khí phổi hoặc tốc độ hình thành CO2 bởi các mô có thể thay đổi pCO2 dịch ngoại bào.
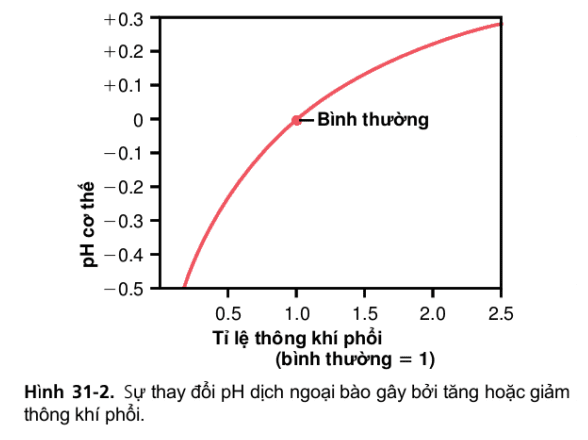
Hình 31-2
TĂNG THÔNG KHÍ PHỔI LÀM GIẢM NỒNG ĐỘ H+ DỊCH NGOẠI BÀO VÀ LÀM TĂNG pH
Nếu chuyển hóa tạo CO2 vẫn không đổi, chỉ có các yếu tố ảnh hưởng đến pCO2 trong dịch ngoại bào là tốc độ thông khí ở phổi. Thông khí phế nang càng cao, pCO2 càng thấp. Như đã thảo luận trước đây, khi CO2 nồng độ tăng lên, nồng độ H2CO3 và H+ cũng tăng lên, do đó làm giảm pH dịch ngoại bào.
Hình 31-2 cho thấy những thay đổi gần đúng pH máu khi tăng hoặc giảm tốc độ thông khí ở phổi. Lưu ý rằng việc tăng thông khí phế nang gấp đôi bình thường làm tăng pH của dịch ngoại bào khoảng 0,23. Nếu pH của dịch cơ thể là 7.40 với thông khí phổi bình thường, tăng gấp đôi tốc độ thông khí làm tăng pH lên khoảng 7.63. Ngược lại, giảm thông khí phế nang đến một phần tư bình thường làm giảm độ pH khoảng 0,45. Vì thế nếu pH 7.4 thông khí phổi bình thường, làm giảm thông khí đến một phần tư bình thường làm giảm độ pH đến 6.95. Bởi vì tỷ lệ thông khí ở phổi có thể thay đổi đáng kể, từ mức thấp 0 đến cao như 15 lần bình thường, người ta có thể dễ dàng hiểu được pH của cơ thể có thể bị thay đổi như thế nào khi thay đổi hoạt động của bộ máy hô hấp.
TĂNG NỒNG ĐỘ H+ LÀM GIẢM THÔNG KHÍ PHẾ NANG
Không chỉ thông khí phế nang ảnh hưởng đến nồng độ H+ thông qua thay đổi pCO2 dịch cơ thể mà nồng độ H+ cũng ảnh hưởng đến thông khí phế nang. Như vậy, Hình 31-3 cho thấy tốc độ thông khí ở phổi tăng 4-5 lần bình thường khi pH giảm từ giá trị bình thường là 7,4 tới giá trị axit mạnh 7.0.
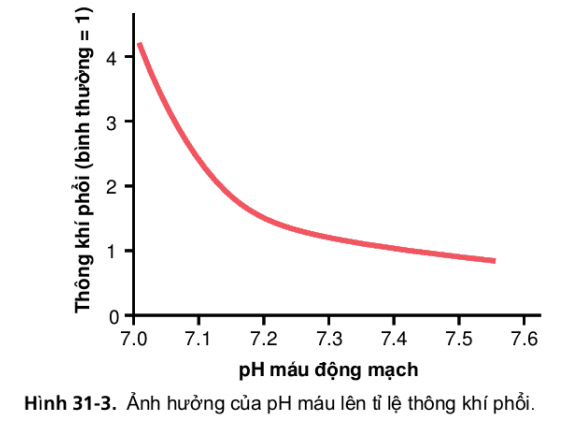
Hình 31-3
Ngược lại, gia tăng pH plasma trên 7.4 gây ra sự sụt giảm tốc độ thông khí. Mức thay đổi tốc độ thông khí/1 đơn vị pH thay đổi khi pH giảm (tương ứng nồng độ H+ cao) lớn hơn nhiều khi pH tăng. Lí do của hiện tương này là khi tốc độ thông khí giảm (như là kết quả của sự tăng pH) lượng oxy đi vào máu sẽ giảm, đồng thời áp suất riêng phần của oxi là pO2 cũng giảm nên kích thích tăng thông khí. Do đó, việc bù hô hấp để tăng pH hầu như không có hiệu quả bằng đáp ứng đó để giảm pH.
Feedback Của Nồng Độ H+ Bởi Hệ Hô Hấp. Bởi vì tăng nồng độ H+ kích thích hô hấp và tăng thông khí ở phổi làm giảm nồng độ H+, vì thế hệ hô hấp hoạt động như một bộ phản hồi feedback cho nồng độ H+.

Bất cứ khi nào nồng độ H+ tăng hơn bình thường, hệ hô hấp sẽ bị kích thích làm tăng thông khí phế nang. Cơ chế này làm giảm pCO2 trong dịch ngoại bào và làm giảm pH về mức bình thường. Ngược lại nếu nồng độ H+ giảm xuống dưới bình thường, trung tâm hô hấp bị ức chế, giảm thông khí ở phổi và nồng độ H+ dần tăng về bình thường.
Hiệu Quả Kiểm Soát Hô Hấp Của Nồng Độ H+. Kiểm soát hô hấp không thể đưa nồng độ H+ hoàn toàn về bình thường trong trường hợp có một nguyên nhân mất cân bằng ngoài hệ hô hấp ảnh hưởng đến pH. Ví dụ, nếu pH đột ngột giảm bằng cách thêm axit vào dịch ngoại bào và pH giảm xuống 7,4-7,0, hệ thống hô hấp có thể giúp pH trở lại đến giá trị khoảng 7,2-7,3. Phản ứng này xảy ra trong vòng 3-12 phút.
Khả Năng Đệm Của Hệ Hô Hấp. Khả năng bù bằng hô hấp của cân bằng acid- base là một loại sinh lý của hệ thống đệm vì nó hoạt động nhanh chóng và giữ cho nồng độ H+ không thay đổi quá nhiều cho đến khi thận từ từ đáp ứng bù lại mất cân bằng kiềm toan. Nhìn chung, khả năng đệm của hệ hô hấp bằng 1-2 lần khả năng đệm của tất cả các hệ đệm hóa học trong cơ thể cộng lại.
Suy Giảm Chức Năng Phổi Có Thể Gây Ra Toan Hô Hấp. Chúng tôi đã thảo luận cho đến nay, hoạt động hô hấp bình thường là để đệm cho sự thay đổi nồng độ H+. Tuy nhiên các bất thường về hô hấp cũng có thể gây ra thay đổi nồng độ H+. Ví dụ, suy giảm chức năng phổi, chẳng hạn như bệnh khí phế thủng, làm giảm khả năng thải CO2 của phổi, gây ra một sự tích tụ CO2 trong dịch ngoại bào nên dễ nhiễm toan hô hấp. Ngoài ra, khả năng đáp ứng với nhiễm toan chuyển hóa bị suy yếu vì khả năng bù bằng hô hấp bị suy giảm. Trong những trường hợp này, thận đại diện cho các cơ chế sinh lý còn lại duy nhất để đưa pH về bình thường sau khi đệm hóa học ban đầu trong dịch ngoại bào đã xảy ra.
VAI TRÒ ĐIỀU HÒA CÂN BẰNG ACID-BASE CỦA THẬN
Thận điều hòa cân bằng acid-base bằng con đường bài tiết cả các ion acid và base theo nước tiểu. Bài tiết nước tiểu acid làm giảm nồng độ acid của dịch ngoại bào trong khi bài tiết nước tiểu base làm giảm nồng độ kiềm.
Cơ chế tổng quát của sự điều hòa này như sau: Một số lượng lớn ion HCO3- được lọc vào trong ống thận, và tiếp tục được thải ra qua nước tiểu, điều này làm giảm nồng độ kiểm máu. Cũng một lượng lớn ion H+ được lọc vào trong ống thận bởi các TB nội mô, làm giảm nồng độ H+ máu. Nếu lượng H+ được bài tiết nhiều hơn là HCO3-, sẽ có sự mất acid hệ thống, ngược lại nếu HCO3- được lọc nhiều hơn, có sự mất kiềm hệ thống.
Mỗi ngày, cơ thể sản xuất khoảng 80 mEq acid cố định, chủ yếu bởi quá trình chuyển hóa protein. Những acid này được gọi là acid cố định (không bay hơi), là bởi vì chúng không thể được thải ra ở phổi như H2CO3. Cơ chế đầu tiên đào thải các acid này là sự bài tiết của thận. Thận cũng đồng thời phải ngăn chặn sự mất HCO3- qua nước tiểu, điều này quan trọng hơn là sự bài tiết các acid cố định. Mỗi ngày, thận lọc khoảng 4320 mEq HCO3-. Ở điều kiện bình thường, hầu hết chúng được tái hấp thu ở ống thận, nhờ đó duy trì nồng độ của hệ đệm chính trong dịch ngoại bào.
Như đã phân tích sau đây, cả sự tái hấp thu HCO3- và sự đào thải H+ được hoàn thành qua hệ thống ống thận. Bởi vì HCO3- cần phải phản ứng với một ion H+ để trở thành H2CO3 trước khi nó được hấp thu, 4320 mEq H+ được loại bỏ mỗi ngày chỉ để tái hấp thu HCO3-. Thêm vào đó, 80 mEq H+ cần phải được bài tiết để làm giảm nồng độ acid do các acid cố định tạo ra mỗi ngày, tổng cộng, mỗi ngày có 4400 mEq H+ được bài tiết vào trong lòng ống thận.
Khi có sự giảm H+ trong dịch ngoại bào (nhiễm kiềm), thận bài tiết ít H+ hơn, như vậy không thể tái hấp thu hoàn toàn HCO3- à làm tăng sự bài tiết HCO3- qua nước tiểu. Do đó, trong nhiễm kiềm, sự mất HCO3- làm tăng nồng độ H+ trong dịch ngoại bào trở lại bình thường.
Trong nhiễm toan, thận bài tiết thêm H+ nhưng không bài tiết HCO3- vào trong nước tiểu mà tái hấp thu hoàn toàn HCO3-, đồng thời tạo HCO3- mới, và cung cấp lại HCO3- cho dịch ngoại bào, nhờ đó làm giảm H+ của dịch ngoại bào xuống.
Như vậy, thận điều chỉnh nồng độ H+ của dịch ngoại bào qua 3 cơ chế chính: (1) Bài tiết H+, (2) Tái hấp thu và lọc HCO3-, (3) Sản xuất HCO3- mới. Tất cả các quá trình này, được hoàn thành bởi cơ chế bài tiết cơ bản, sẽ được nói trong phần tiếp theo.
SỰ BÀI TIẾT H+ VÀ SỰ TÁI HẤP THU HCO3- Ở ỐNG THẬN
Sự bài tiết ion H+ và tái hấp thu HCO3- xảy ra ở hầu hết các phần của ống thận trừ nhánh xuống và phần mảnh của nhánh lên quai Henle. Hình 31-1 đã tổng kết quá trình tái hấp thu HCO3- dọc theo ống thận. Luôn nhớ rằng với mỗi HCO3- được tái hấp thu, một ion H+ được đào thải.
Khoảng 80-90% HCO3- tái hấp thu (và H+ bài tiết) được thực hiện ở ống lượn gần, chỉ một số ít HCO3- xuống ống lượn xa và ống góp. Ở đoạn dày của nhánh lên quai Henle, khoảng 10% HCO3- nữa được tái hấp thu, và phần còn lại được hấp thu ở ống lượn xa và ống góp. Như đã nói trước, cơ chế hấp thu của HCO3- cũng bao gồm cả sự bài tiết H+, nhưng có sự khác biệt về vị trí thực hiện hai nhiệm vụ này.
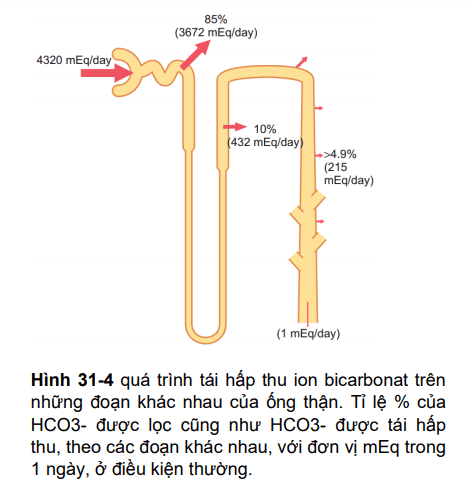
Hình 31-4
Hình 31-5
H+ ĐƯỢC BÀI TIẾT BỞI SỰ HOẠT HÓA LẦN 2 Ở PHẦN ĐẦU CỦA HỆ THỐNG ỐNG THẬN.
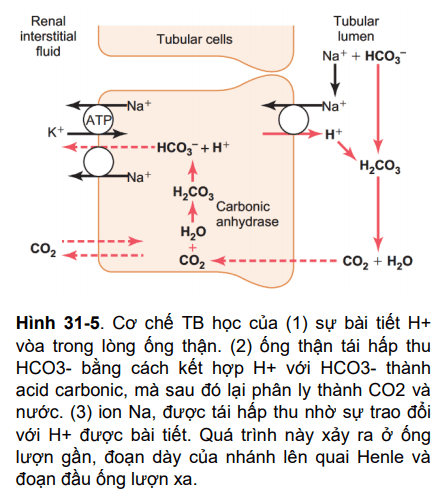
TB biểu mô của ống lượn gần, phần dày của nhánh lên quai Henle và đoạn đầu ống lượn xa đều bài tiết H+ nhờ kênh Na-H, được biểu diễn ở hình 31-5. Cơ chế bài tiết này hoạt động theo cặp với sự vận chuyển Na vào TB ở màng sinh chất bởi kênh NaH, và năng lượng cho sự bài tiết H+ chống lại Gradien được lấy từ sự di chuyển theo gradien của Na+ vào TB. Gradien Na này lại được tạo ra bởi kênh Na-K ATPase, trên màng TB. Khoảng 95% HCO3- được tái hấp thu theo cách này, đáp ứng nhu cầu bài tiết khoảng 4000 mEq H+ của cơ thể mỗi ngày.
Cơ chế này, tuy vậy không hoàn toàn thích hợp khi nồng độ H+ đã quá cao trong lòng ống. Dịch trong ống thận lúc này trở nên rất acid trong các ống lượn xa và ống góp.
Hình 31-5 cho thấy cách thức H+ được bài tiết đồng thời với HCO3- được tái hấp thu. Quá trình này bắt đầu khi CO2 hoặc được khuếch tán từ trong lòng ống thận vào TB ống thận hoặc được tạo ra do chuyển hóa, kết hợp với nước để tạo thành H2CO3, sau đó phân ly thành HCO3- và H+. H+ thì được bài tiết ra khỏi TB ống thận vào trong lòng ống bởi kênh Na-H. Điều này xảy ra khi có một ion Na được trao đổi với H+: đầu tiên Na gắn vào một protein mang trên màng TB thành ống bên ngoài, cùng lúc, một ion H+ được gắn vào phần trong TB của protein này, sau đó hai thành phần này được trao đổi qua kênh. Na di chuyển vào TB theo gradien nồng độ được tạo ra bởi bơm Na-K ATPase trên màng TB phần tiếp xúc với dịch kẽ. Gradien này cung cấp năng lượng cho Na di chuyển vào trong TB đồng thời cũng làm cho H+ di chuyển sang bên đối diện, từ bên trong TB thành ống.
HCO3- sinh ra trong TB sau khi phân ly H2CO3 sau đó được vận chuyển vào dịch gian bào của ống thận, và sau đó trở về tuần hoàn. Kết quả là H+ hệ thống được đào thải vào trong lòng ống thận và HCO3- được tái hấp thu vào máu.
HCO3- ĐƯỢC LỌC SAU ĐÓ TÁI HẤP THU BỞI SỰ TƯƠNG TÁC VỚI H+ TRONG ỐNG THẬN
Ion bicarbonat không hề thấm dễ dàng qua màng TB ống thận, do đó HCO3- được lọc ra ở tiểu cầu thận không thể được tái hấp thu trực tiếp. Thay vào đó, HCO3- được tái hấp thu bởi một quá trình đặc biệt mà trong đó, đầu tiên nó phải được tổ hợp với H+ thành H2CO3, rồi phân ly thành CO2 và nước, được thể hiện ở hình 31-5
Quá trình tái hấp thu này được khởi đầu bởi một phản ứng trong ống thận giữa HCO3- được lọc ra ở cầu thận và H+ được bài tiết bởi TB thành ống thận. H2CO3 tạo ra trong quá trình này phân ly ngay thành CO2 và nước, CO2 có thể dễ dàng khuếch tán qua màng TB ống để vào trong TB ống thận, nơi mà nó được phản ứng với nước để tạo thành một phân tử H2CO3 mới dưới xúc tác của Carbonic anhydrase. H2CO3 này lại phân ly thành HCO3- và H+, HCO3- khuếch tán vào trong dịch gian bào và được mang về tuần hoàn cơ thể.
Sự vận chuyển HCO3- qua màng TB vào mô kẽ được thực hiện bởi 2 cơ chế: (1) kênh Na+-HCO3- trên màng TB ống lượn gần và (2) kênh Cl-HCO3- ở đoạn cuối ống lượn gần, đoạn dày nhánh lên quai Henle, và ống góp.
Như vậy mỗi H+ được tạo thành trong lòng TB ống thận thì một HCO3- cũng đồng thời được tạo ra và giải phóng vào máu. Ảnh hưởng hệ thống của phản ứng này là sự tái hấp thu HCO3- từ lòng ống thận dù phân tử HCO3- đi vào dịch kẽ không phải là phân tử HCO3- được lọc ra trước đó. Sự tái hấp thu dịch lọc này không ảnh hưởng đến dự trữ H+ của hệ thống vì H+ dự trữ gắn với HCO3- trong dịch lọc, và do đó không được bài tiết ra ngoài.
HCO3- được “chuẩn độ” bởi H+ trong lòng ống thận. Ở điều kiện thường, tỉ lệ H+ bài tiết khoảng 4400 mEq/ngày, và tỉ lệ lọc của HCO3- khoảng 4320 mEq/ngày. Như vậy, số lượng 2 ion này tiến vào ống thận là tương đương nhau, chúng kết hợp với nhau và tạo thành CO2 và nước. Do đó, người ta nói rằng HCO3- và H+ bình thường “chuẩn độ” nhau trong dịch lọc.
Sự “chuẩn độ” này không phải bao giờ cũng hoàn toàn chính xác vì thường có sự vượt hơn nhẹ của H+ (khoảng 80 mEq/ngày) giải thoái cho cơ thể khỏi sự ngộ độc các acid cố định tạo ra do chuyển hóa. Như sẽ giải thích sau đây, hầu hết H+ này không được bài tiết dưới dạng tự do mà thường là trong sự kết hợp với các yếu tố khác của hệ đệm trong nước tiểu, như ion phosphat và NH3.
Khi có sự vượt lên quá mức của HCO3 so với H+ trong nước tiểu, như trong kiềm chuyển hóa, lượng HCO3- tăng lên này không thể được tái hấp thu, do đó, lượng HCO3- này tồn dư trong lòng ống thận và được bài tiết ra ngoài trong nước tiểu. Giúp xừ lý tình trạng nhiễm kiềm chuyển hóa.
Trong nhiễm toan, có sự tăng H+ so với HCO3- làm tăng sự tái hấp thu HCO3- đến mức tái hấp thu hoàn toàn HCO3-. H+ được bài tiết vào trong nước tiểu dưới dạng các tổ hợp với các đệm của nước tiểu đặc biệt là ion phosphat và NH3. Như vậy cơ chế căn bản của sự điều tiết cân bằng acid-base của thận là bởi sự cân bằng không hoàn toàn giữa nồng độ H+ với HCO3-. Bài tiết một trong hai ion vào trong nước tiểu và lấy đi chúng từ dịch ngoại bào.
HOẠT HÓA THỨ NHẤT CỦA H+ TRONG QUÁ TRÌNH BÀI TIẾT Ở ĐOẠN CUỐI ỐNG LƯỢN XA VÀ ỐNG GÓP.
Bắt đầu từ đoạn cuối ống lượn xa và tiếp tục cho đến hết đoạn còn lại của hệ thống ống thận, các tb biểu mô ống bài tiết H+ nhờ kênh hoạt hóa thứ nhất. Tính chất của quá trình vận chuyển này khác với cơ chế đã nói ở trên của ống lượn gần một phần quai Henle và đoạn đầu ống lượn xa đã trình bày ở trên.
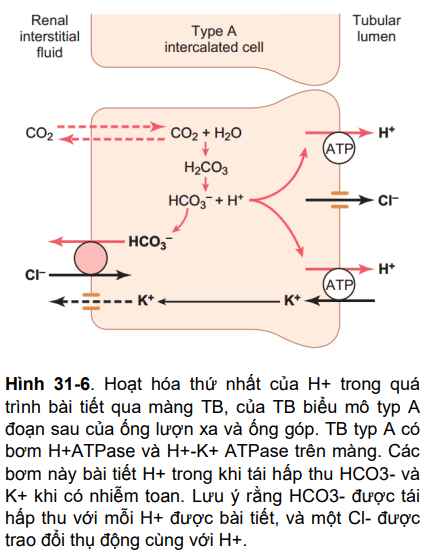
Hình 31-6
Cơ chế của sự hoạt hóa thứ nhất của H+ được trình bày ở chương 28, và được tóm tắt ở hình 31- 6. Nó xảy ra ở màng TB ống thận, khi H+ được vận chuyển trực tiếp bởi một protein đặc hiệu, một bơm H+ATPase và một bơm H+-K+ATPase. Năng lượng cần thiết cho các protein này được lấy từ sự phân giải ATP thành ADP.
Hoạt hóa thứ nhất của H+ xảy ra trong một TB đặc biệt gọi là TB typ A của đoạn cuối ống lượn xa và ống góp. Ion H+ trong các TB này được bài tiết qua 2 bước: (1) CO2 trong TB phản ứng với nước tạo ra H2CO3, và (2) H2CO3 phân ly thành HCO3-, rồi được tái hấp thu vào máu, ion H+ thì được bơm ra bởi một trong hai loại protein trên. Với mỗi H+ được bài tiết, một HCO3- được tái hấp thu, tương tự như là quá trình ở ống lượn gần. Khác biệt chính là H+ di chuyển qua màng bởi một bơm H+ chủ động thay vì một kênh protein hai chiều như ở phần trước của nephron.
Mặc dù sự bài tiết H+ ở đoạn cuối ống lượn xa và ống góp chỉ chiếm khoảng 5% của tổng H+ bài tiết. Nhưng cơ chế này rất quan trọng trong việc acid hóa tối đa nước tiểu. Ở ống lượn gần, nồng độ H+ có thể được làm tăng lên 3-4 lần và PH của dịch lọc có thể giảm còn 6.7, mặc dù một lượng lớn H+ được bài tiết bởi đoạn này của Nephron nhưng nồng độ H+ còn có thể được làm tăng lên tới 900 lần ở ống góp. Cơ chế này làm giảm pH của dịch lọc xuống tới 4.5, độ pH thấp hơn cả giới hạn dưới của pH nhu mô thận có thể đạt được.
KẾT HỢP H+ DƯ THỪA VỚI PHOSPHAT VÀ AMINO Ở HỆ THỐNG ĐỆM TẠO RA HCO3 MỚI TRONG ỐNG LƯỢN
Khi H+ được bài tiết vượt quá mức của HCO3 hấp thu vào trong dịch ở ống thận, chỉ có một phần nhỏ H+ sư thừa được bài tiết dưới dạng ion trong nước tiểu. Đây là do độ pH nước tiểu tối thiểu khoảng 4,5 tương ứng với nồng độ H+ là 10^-4,5 mEq/l hay 0,03 mEq/l. Như vậy, đối với mỗi lít nước tiểu được hình thành, tối đa chỉ bài xuất khoảng 0,03 mEq H+ tư do. Để có thể bài tiết ra 80mEq acid không bay hơi được hình thành từ sự trao đổi chất mỗi ngày thì có khoảng 2667 l nước tiểu phải được đào thải nếu H+ tự do vẫn trong dung dịch.
Thải ra một lượng lớn H+ (như 500 mEq/ngày) trong nước tiểu được thực hiện chủ yếu bằng cách kết hợp H+ với hệ thống đệm trong dung dịch. Các bộ đệm quan trọng nhật là bộ đệm phosphate và bộ đệm ammoniac. Ngoài ra còn có có hệ thống đệm yếu khác như đệm urat và citrate nhưng ít quan trọng hơn.
Khi H+ được chuẩn độ trong ống thận với HCO3- điều này dẫn đến sự tái hấp thu một HCO3 cho mỗi H+ tiết ra như đã nói ở trước đó. Tuy nhiên, khi có quá nhiều H+ ở trong ống thận, nó kết hợp với hệ thống đệm khác hơn HCO3-, điều này dẫn đến HCO3 mới được tạo ra cũng có thể đi vào máu. Do đó, khi có quá nhiều H+ trong dịch ngoài bào, thận không chỉ hấp thu tất cả các HCO3 đã lọc mà còn tạo HCO3- mới qua đó giúp bổ sung lượng HCO3- mất từ dịch ngoại bào trong nhiễm toan. Trong 2 phần tiếp theo chúng ta sẽ bàn về cơ chế mà các bộ đệm phosphate và amoniac đóng góp tạo ra lượng HCO3- mới.
CƠ CHẾ HỆ THỐNG ĐỆM PHOSPHAT MANG H+ DƯ VÀO NƯỚC TIỂU VÀ TẠO RA THẾ HỆ HCO3 MỚI
Hệ thống đệm phosphate gồm HPO4= và HPO4-. Cả hai tạo thành tập trung ở dịch ống thận vì nước thường được tái hấp thu đến một mức độ lớn hơn so với phosphate ở ống thận. Do đó, mặc dù phosphate không phải một hệ thống đệm dịch ngoại bào quan trọng, nhưng nó hiệu quả hơn nhiều như một bộ đệm trong dịch ống thận.
Một yếu tố khác làm cho hệ đệm phosphate quan trọng như là một bộ đệm ống do trên thực tế pK của hệ đệm này là gần 6,8. Trong điều kiện bình thường, nước tiểu có tính acid nhẹ và độ pH của nước tiểu là gần pK của hệ thống đệm phosphate. Vì vậy, trong các ống thận, hệ thống đệm phosphate thông thường có chức năng hiệu quả nhất gần phạm vi pH.
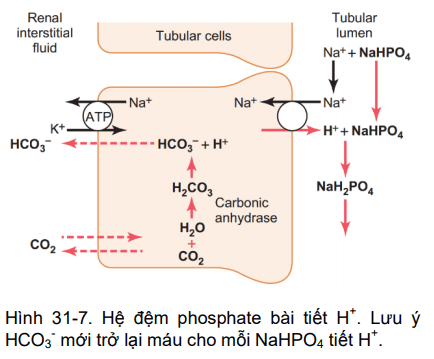
Hình 31-7
Hình 31-7 cho thấy trình tự của sự kết hợp của H+ được bài tiết với bộ đệm phosphate và cơ chế HCO3- mới được thêm vào máu. Quá trình H+ bài tiết vào ống thận giống như mô tả trước đó. Miễn là có HCO3 dư thừa trong dịch ống thận thì hầu hết H+ dư thừa kết hợp với HCO3-.
Tuy nhiên, khi tất cả HCO3- đã được tái hấp thu và không còn có sẵn để kết hợp với H+ thì H+ dư có thể kết hợp với HPO4= và bộ đệm khác. Sau khi H+ kết hợp với HPO4= để tạo thành H2PO4-, nó có thể được đào thải dưới dạng muối natri (NaH2PO4), mang theo H+ dư thừa.
Tuy nhiên, có một sự khác biệt quan trọng trong đào thải H+ ở chuỗi này đã thảo luận trước đó. Trong trường hợp này, HCO3- được tạo ra trong các tế bào ống thận và đi vào mao mạch thận (động mạch-tĩnh mạch) đại diện cho một lợi ích ròng của HCO3 trong máu chứ không phải chỉ đơn thuần là sự thay thế HCO3 được lọc. Vì vật, khi nào một H+ được bài tiết và trong lòng ống thận mà kết hợp với bộ đệm khác (không phải đệm bicacbonat) hiệu quả thuần là bổ sung một HCO3- mới vào máu. Quá trình này cho thấy một trong những cơ chế mà thận có thể bổ sung HCO3- vào dịch ngoại bào.
Trong điều kiện bình thường, phần lớn các phosphate được tái hấp thu và chỉ khoảng 30-40 mEq/ngày dành cho đệm H+. Do đó, phần lớn các bộ đệm với H+ dư trong dịch toan ở ống thận xảy ra thông qua hệ đệm ammoniac.
SỰ BÀI TIẾT H+ VÀ TẠO HCO3- CỦA HỆ ĐỆM AMONIAC
Amoniac là hệ đệm thứ hai trong ống thận, thậm chí còn quan trọng hơn hệ đệm phosphate. Hệ đệm bao gồm amoniac (NH3) và ion amoni (NH4+). Ion amoni được tổng hợp từ glutamine, mà xuất phát chủ yếu từ sự trao đổi chất của axit amin trong gan. Glutamine đến thận được vận chuyển vào tế bào biểu mô của ống lượn gần, tăng dần khi đi qua quai Henle và ống lượn xa (Hình 31-8). Bên trong tế bào, mỗi phân tử của glutamine được chuyển hóa bằng một loạt các phản ứng để cuối cùng tạo thành 2 NH4 + và 2 HCO3-. Ion NH4 + được bài tiết vào trong lòng ống bằng một cơ chế đồng vận chuyển với natri, đó là tái hấp thu. Ion HCO3- được vận chuyển qua màng, cùng với sự tái hấp thu Na + vào dịch kẽ và được vận chuyển bởi các mao mạch cầu thận. Mỗi phân tử glutamine chuyển hóa ở ống gần tạo ra 2 NH4 + được bài tiết vào nước tiểu và 2 HCO3- được tái hấp thu vào máu. HCO3- tạo ra bởi quá trình này tạo thành HCO3- mới.
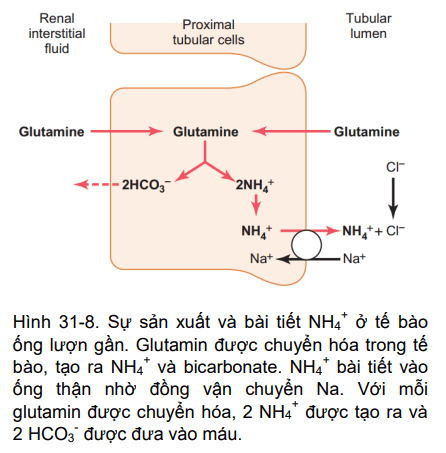
Hình 31-8
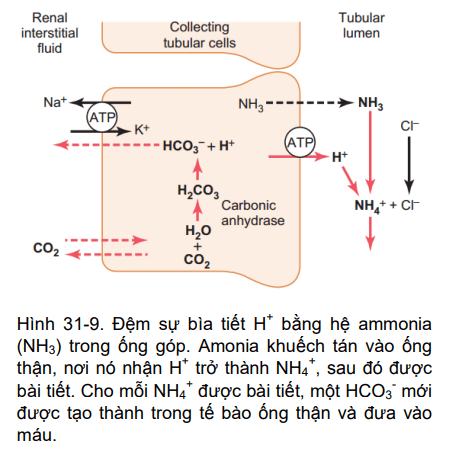
Hình 31-9
Trong ống góp, bổ sung NH4+ xảy ra thông qua một cơ chế khác (Hình 31-9). Dưới đây, H + được tiết ra bởi các màng tế bào vào trong lòng ống, nơi mà nó kết hợp với NH3 để hình thành NH4+, sau đó được bài tiết ra ngoài. NH3 thấm qua tế bào ống góp, mà có thể dễ dàng đi qua màng tế bào trong lòng ống. Tuy nhiên, màng này lại ít nhiều cho NH4+ thấm qua. Vì vậy, một khi H + đã phản ứng với NH3 để tạo thành NH4 +, các NH4 + này bị mắc kẹt trong lòng ống và bị đào thải ra ngoài qua nước tiểu. Đối với mỗi NH4 + bài tiết, một HCO3- mới được tạo ra và thêm vào máu.
Nhiễm toan mạn gây tăng tiết NH4 +. Một trong các chức năng quan trọng nhất của hệ thống đệm amoniac là nó chịu sự kiểm soát sinh lý. Sự gia tăng trong H + kích thích sự trao đổi chất glutamine tại thận do đó làm tăng sự hình thành của NH4 + và HCO3- mới, ngược lại khi H+ giảm sẽ ức chế sự trao đổi chất glutamine tại thận làm giảm sự hình thành của NH4 + và HCO3- mới.
Trong điều kiện bình thường, lượng H + bị đào thải bởi hệ đệm amoniac trong khoảng 50% lượng axit đào thải và 50% lượng HCO3- mới được tạo ra bởi thận. Tuy nhiên, khi nhiễm toan mạn tính, tỷ lệ NH4 + bài tiết có thể tăng lên đến nhiều nhất là 500 mEq/ngày. Do đó, với nhiễm toan mãn tính, cơ chế axit được loại bỏ là bài tiết NH4+. Quá trình này cũng cung cấp nhiều nhất cơ chế quan trọng để tạo ra HCO3- mới trong nhiễm toan mãn tính.
ĐỊNH LƯỢNG BÀI TIẾT ACID-BASE THẬN
Dựa trên các nguyên tắc trên, chúng ta có thể định lượng acid thận bài tiết hoặc lượng hấp thu hay thải trừ HCO3 – từ máu như sau:
Bài tiết bicarbonate được tính bằng tích của thể tích nước tiểu với nồng độ HCO3 – niệu. Con số này chỉ ra nhanh chóng lượng HCO3 – loại bỏ khỏi máu (tương tự như thêm H+ vào máu). Trong nhiễm toan, sự mất HCO3 – giúp đưa pH trở lại bình thường.
Lượng HCO3 – mới góp vào máu ở bất kỳ thời điểm nào bằng lượng H+ tiết ở cuối ống thận với hệ đệm niệu non-bicarbonat. Như thảo luận từ trước, hệ đệm niệu non-bicarbonat gồm NH4 + và phosphate. Do đó, lượng HCO3 – thêm vào máu (và H + bài tiết bởi NH4 +) được tính bằng đo lượng bài tiết NH4 + (thể tích nước tiểu nhân với nồng độ NH4 + ).
Phần còn lại của đệm non-bicarbonat, non-NH4 + trong nước tiểu được tính bằng cách xác định giá trị gọi là acid chuẩn độ. Lượng acid chuẩn độ trong nước tiểu tính bằng nước tiểu chuẩn độ với một base mạnh, như NaOH, với pH 7.4, pH máu bình thường, và pH dịch lọc cầu thận. Do đó, số mEq của NaOH cần tìm để đưa pH niệu về 7.4 bằng lượng mEq H+ được thêm vào dịch ống thận, được kết hợp với phosphate và các hệ đệm khác. Định lượng acid chuẩn độ không bao gồm H+ trong NH4 + vì pK của NH3-NH4 + đạt tới 9.2, và chuẩn độ với NaOH tới pH 7.4 không làm mất H+ trong NH4 +.
Vì vậy, sự bài tiết acid thuần bởi thận có thể tính bằng:
Acid bài tiết thuần = NH4 + bài tiết + acid chuẩn độ niệu – HCO3 – bài tiết.
Lí do loại trừ HCO3 – bài tiết vì sự mất HCO3 – giống như sự thêm H+ vào máu. Để cân bằng acidbase, lượng acid bài tiết thuần phải bằng lượng acid sản xuất không bay hơi trong cơ thể. Trong nhiễm toan, acid bài tiết thuần tăng rõ rệt, đặc biệt do tăng tiết NH4 +, do đó loại bỏ acid ra khỏi máu. Lượng acid bài tiết thuần cũng bằng lượng HCO3 – thuần thêm vào máu. Vì vậy, trong nhiểm toan, sự thêm HCO3 – vào máu nhiều hơn NH4 + và acid niệu chuẩn độ được bài tiết.
Trong nhiễm kiềm, acid chuẩn độ và NH4 + bài tiết giảm đến 0, trong khi tăng bài tiết HCO3 -. Do đó, lượng acid thuần bài tiết âm, nghĩa là có sự mất thuần HCO3 – từ máu (giống như thêm H+ vào máu) và không có HCO3 – mới được tạo bởi thận.
QUY CHẾ TIẾT H+ CỦA ỐNG THẬN
Như đã thảo luận trước đó, H + bài tiết bởi các tế bào biểu mô ống thận là cần thiết cho cả hai quá trình tái hấp thu HCO3- và HCO3- mới tạo ra liên quan đến sự hình thành acid chuẩn độ. Vì thế lượng H+ tiết ra phải được quy định một cách cẩn thân để thận có thể thực hiện hiệu quả chức năng của mình trong việc điều chỉnh cân bằng acid-base.
Trong điều kiện bình thường, các tế bào ống thận phải tiết ra lượng H+ ít nhất đủ để tái hấp thu toàn bộ lượng HCO3- được lọc và còn phải đủ H+ để đảm bảo acid chuẩn độ hoặc đủ lượng NH4+ để đào thải các acid không bay hơi được tạo ra mỗi ngày bởi chuyển hóa.
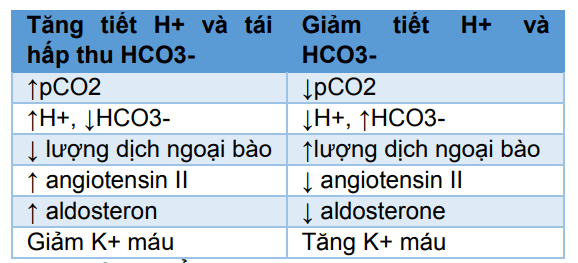
Bảng 31-2
Trong nhiễm kiềm, lượng H+ tiết ra ở ống thận không đủ để tái hấp thu hoàn toàn HCO3- , tạo điều kiện cho thận tăng đào thải HCO3-. Trong điều kiện này, acid chuẩn độ và ammoniac không được đào thải vì không đủ H+ để kết hợp với bộ đệm khác bicacbonat, do đó không có HCO3- dư thừa thêm vào máu trong nhiễm kiềm. Trong nhiễm toan, các ống thận tăng tiết H+ đủ để hấp thu hoàn toàn HCO3- lọc với đủ H + còn lại để bài tiết một lượng lớn NH4 + và axit chuẩn độ, góp một lượng lớn HCO3- mới vào tổng số dịch ngoại bào cơ thể. Các kích thích quan trọng nhất để tăng tiết H+ ở ống thận là (1) tăng pCO2 trong dịch ngoại bào trong nhiễm toan hô hấp hoặc (2) tăng H+ dịch ngoại bào (giảm pH) trong nhiễm toan chuyển hóa hoặc hô hấp.
Các tế bào ống thận đáp ứng trực tiếp với sự tăng pCO2 máu trong nhiễm toan hô hấp như sau: Tăng pCO2 trong máu làm tăng pCO2 trong tế bào ống thận làm tế bào ống thận tăng tạo ra H+ do đó kích thích sự tiết H+ của tế bào ống thận. Yếu tố thứ hai kích thích tiết H+ là tăng nồng độ H+ dịch ngoại bào (giảm pH).
Dưới một số điều kiện sinh lý bệnh, một yếu tố đặc biệt có thể làm tăng tiết H+ là sự bài tiết aldosterone quá mức. Aldosteron kích thích bài tiết H+ bởi các tế bào kẽ ở ống góp. Do đó bài tiết quá nhiều aldosteron như ở những người có hội chứng Conn, có thể làm tăng bài tiết H+ vào dịch lọc, vì thế tăng lượng HCO3- thêm trở lại máu. Bởi thế thường có hiện tượng nhiễm kiềm ở bệnh nhân tăng tiết aldosterone nhiều.
Các tế bào ống thận thường đáp ứng với sự giảm nồng độ H+ (kiềm) bằng cách giảm tiết H+. Việc giảm tiết H+ là do giảm pCO2 ngoại bào trong nhiễm kiềm hô hấp, hoặc do giảm nồng độ H+ mỗi giây trong nhiễm kiềm hô hấp hoặc chuyển hóa.
Bảng 31-2 tốm tắt các yếu tố ảnh hưởng đến tiết H+ và tái hấp thu HCO3- . Một số yếu tố không liên quan trực tiếp đến quá trình cân bằng acid – base. Ví dụ, sự tiết H+ xảy ra đồng thời với tái hấp thu Na+ do đồng vận Na+-H+ ở ống lượn gần và đoạn xuống quai Henle. Do đó các yếu tố kích thích tái hấp thu Na+, chẳng hạn như giảm thể tích dịch ngoại bào, cũng có thể làm tăng cả tiết H+ cũng như tái hấp thu HCO3- .
Giảm thể tích dịch ngoại bào làm tăng tái hấp thu Na+, qua đó làm tăng tiết H+ và tái hấp thu HCO3- qua nhiều cơ chế, bao gồm (1) tăng nồng độ angiotensin II, trực tiếp kích thích sự hoạt động của kênh Na + -H + ở ống thận, và (2) tăng aldosterone làm tăng tiết H+ do các tế bào kẽ ở ống góp. Do đó giảm thể tích dịch ngoại bào có xu hướng gây nhiễm kiềm do tăng tiết nhiều H+ và tái hấp thu HCO3- ở ống thận.
Bảng 31-2 Những yếu tố của huyết tương hay dịch ngoại bào ảnh hưởng đến sự tiết H+ cũng như tái hấp thu HCO3- ở tế bào ống thận.
Những thay đổi về nồng độ K+ trong huyết tương cũng có thể ảnh hưởng đến sự tiết H+ của ông thận. Hạ kali máu kích thích và tăng kali máu ức chế H + bài tiết ở ống lượn gần. Giảm nồng độ kali huyết có xu hướng tăng H + tập trung trong các tế bào ống thận. Điều này, kích thích H + bài tiết và tái hấp thu HCO3- và dẫn đến nhiễm kiềm. Tăng kali máu giảm H + bài tiết và tái hấp thu HCO3- và có xu hướng gây nhiễm toan.
CƠ CHẾ BÙ TRỪ THẬN TRONG NHIỄM TOAN: TĂNG TIẾT H+ VÀ TĂNG TÁI HẤP THU HCO3 –
Bây giờ chúng ta mô tả cơ chế thận bài tiết H+ và tái hấp thu HCO3 -, chúng ta có thể giải thích cách thận điều hòa pH dịch ngoại bào khi nó biến đổi.
Nhận thấy ở phương trình 8, phương trình Henderson – Hasselbalch, nhiễm toan xảy ra khi tỉ lệ HCO3 – /CO2 trong dịch ngoại bào giảm, gây ra giảm pH. Nếu rỉ lệ này giảm do giảm HCO3-, ta có nhiễm toan chuyển hóa. Còn nếu pH giảm bởi tăng PCO2, nhiễm toan là nhiễm toan acid.
NHIỄM TOAN GÂY GIẢM HCO3 – /H+ TRONG DỊCH ỐNG THẬN
Cả nhiễm toan hô hấp và chuyển hóa đều gây giảm tỉ lệ HCO3 – /H+ trong dịch ống thận. Như một kết quả, sự quá mức H+ trong ống thận làm giảm tái hấp thu HCO3 – và để lại thêm H+ có sẵn để kết hợp với bộ đệm tiết niệu NH4+ và HPO4–. Như vậy, trong nhiễm toan, thận tái hấp thu cả HCO3 – lọc trên và từ HCO3 – mới thông qua phản ứng của NH4+ và acid chuẩn độ.
Trong nhiễm toan chuyển hóa, sự quá mức H+ so với HCO3 – xảy ra trong dịch ống thận chủ yếu do giảm lọc HCO3 -. Điều này là do sự giảm nồng độ HCO3 – trong dịch ngoại bào.
Trong nhiễm toan hô hấp, sự quá mức H+ trong dịch ống thận chủ yếu vì tăng nồng độ PCO2 dịch ngoại bào, làm kích thích tiết H+.
Như đã bàn luận ở trước, trong nhiễm toan mạn, dù do hô hấp hay chuyển hóa, có sự gia tăng sản xuất NH4 +, đóng góp tăng bài tiết H+ và tăng HCO3 – mới trong dịch ngoại bào. Với nhiễm toan mạn trầm trọng, H+ có thể bài tiết đến 500 mEq/ngày trong nước tiểu, chủ yếu từ NH4 +; sự bài tiết này góp phần tới 500 mEq/ngày HCO3 – mới vào máu.
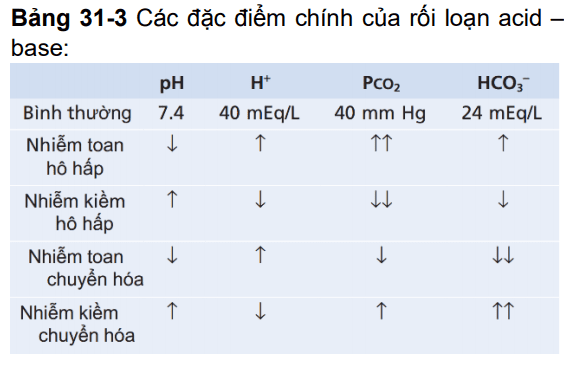
Bảng 31-3
Các biến đổi chính được mô tả bằng dấu ↑↑ hoặc↓↓. Lưu ý, các rối loạn acid base hô hấp bắt đầu bằng sự tăng hay giảm PCO2, còn các rối loạn chuyển hóa được bắt đầu bằng sự tăng hay giảm HCO3 – .
Như vậy, trong nhiễm toan mạn, sự tăng bài tiết H + qua ống thận giúp loại bỏ H + dư thừa và tăng lượng HCO3 – trong dịch ngoại bào. Quá trình này làm tăng HCO3 – trong hệ đệm bicarbonat, theo phương trình Henderson-Hasselbalch, làm tăng pH ngoại bào và sửa chữa sự nhiễm toan. Nếu nhiễm toan chuyển hóa, sự tăng thông khí làm giảm PCO2 cũng giúp sửa nhiễm toan.
Bảng 31-3 tóm tắt các đặc tính liên quan đến nhiễm toan hô hấp và chuyển hóa, cũng như nhiễm kiềm hô hấp và chuyển hóa sẽ được đề cập dưới đây. Lưu ý, trong nhiễm toan hô hấp, sự giảm pH, tăng nồng độ H + dịch ngoại bào, và tăng PCO2 gây nên tình trạng toan. Đáp ứng bù trừ là sự tăng HCO3 – huyết tương từ thận. Sự tăng này giúp bù trừ tình trạng tăng PCO2, từ đó đưa pH máu trở lại bình thường.
Trong nhiễm toan chuyển hóa, cũng có sự giảm pH và tăng nồng độ H + ngoại bào. Tuy vậy, trong trường hợp này, bất thường đầu tiên là sự giảm HCO3 -. Cơ chế bù trừ đầu tiên bao gồm tăng thông khí, làm giảm PCO2, và sự bù của thận bằng cách thêm HCO3 – mới vào dịch ngoại bào, giúp giảm thiểu sự mất HCO3 – ngoại bào.
Điều chỉnh của thận trong nhiễm kiềm – giảm đào thải H+ ở ống thận và tăng hấp thu HCO3 –
Bù trừ trong nhiễm kiềm về cơ bản đối nghịch với trường hợp nhiễm toan. Ở người nhiễm kiềm, tỉ lệ HCO3 – / CO2 ngoại bào tăng lên, dẫn tới pH tăng, thể hiện trong công thức Henderson-Hasselbalch.
Nhiễm kiềm gây tăng tỉ số HCO3 – /H+ trong nước tiểu ở ống thận
Nhiễm kiềm cho dù nguyên nhân là do rối loạn hô hấp hay chuyển hóa đều có tỉ số HCO3 – /H+ trong ống thận tăng. Nguyên nhân thực sự gây tăng nồng độ HCO3 – là sự không tái hấp thu HCO3 – ở ống thận mà đào thải qua nước tiểu. Trong nhiễm kiềm, HCO3 – đào thải từ dịch ngoại bào qua thận, có tác dụng tương tự việc tăng giữ H + ở dịch ngoại bào. Cơ chế này giúp giữ cho Ph trở về giá trị bình thường. Bảng 31-3. cho thấy tất cả các đặc tính của kiềm hô hấp và kiềm chuyển hóa. Trường hợp nhiễm kiềm hô hấp, có hiện tượng tăng pH ngoại bào và giảm nồng độ H +. Căn nguyên gây nhiễm kiềm là giảm PCO2 và kéo theo giảm tiết H+ ở ống thận. Kết quả là không có đủ H + trong nước tiểu ở ống thận để phản ứng với HCO3 -. Vì vậy, HCO3 – sẽ tăng đào thải và giảm tái hấp thu, dẫn tới giảm bù và nhiễm kiềm. Do đó, phản ứng bù trừ cơ bản trong nhiễm kiềm hô hấp là giảm nồng độ HCO3 -. Trong nhiễm kiềm chuyển hóa cũng có sự sụt giảm nồng độ H + và tăng pH. Nguyên nhân gây kiềm hóa lại do tăng nồng độ HCO3 – trong dịch ngoại bào. Cơ thể có cơ chế bù trừ bằng cách giảm nhịp thở nhằm tăng PCO2 và đưa pH về giá trị bình thường. Thêm nữa, Nồng độ HCO3 – dịch ngoại bào tăng làm giảm vận chuyển HCO3 -, dẫn tới tăng tỉ lệ HCO3 – /H+ trong nước tiểu ống thận. Nồng độ HCO3 – trong nước tiểu ống thận tuy cao nhưng không tái hấp thu được do không có H+ kết hợp. Vì vậy HCO3 – sẽ đào thải ra ngoài qua nước tiểu. Trong nhiễm kiềm chuyển hóa, cơ chế bù trừ chính là tăng PCO2 thông qua tăng đào thải HCO3 -.
CÁC NGUYÊN NHÂN RỐI LOẠN ACID-BASE TRÊN LÂM SÀNG
Từ các chương bàn luận trước, chúng ta đã biết rằng bất kì nguyên nhân nào làm giảm thông khí ở phổi đều làm tăng pCO2 dịch ngoại bào. Điều này làm tăng nồng độ H2CO3 và H+ dẫn đến nhiễm toan. Bởi vì nguyên nhân nhiễm toan là bất thường của hô hấp nên trường hợp này được gọi là nhiễm toan hô hấp.
Toan hô hấp xảy ra trong các bệnh lý có tổn thương trung tâm hô hấp hoặc các bệnh lý giảm khả năng đào thải CO2 của phổi. Ví dụ: tổn thương trung tâm hô hấp ở hành não có thể dẫn đến nhiễm toan hô hấp. Ngoài ra, tắc nghẽn đường hô hấp, viêm phổi, khí thũng, giảm diện tích màng trao đổi khí của phổi, các yếu tố cản trở trao đổi khí giữa máu và không khí phế nang đều gây nhiễm toan hô hấp.
Trong nhiễm toan hô hấp, các đáp ứng bù trừ gồm có (1) hệ đệm của dịch cơ thể và (2) thận, đòi hỏi vài ngày để bù trừ cho rối loạn.
Tăng thông khí và giảm pCO2 dẫn đến nhiễm kiềm hô hấp
Nhiễm kiềm hô hấp là do thông khí quá mức của phổi. Hiếm khi điều này xảy ra do các tình trạng bệnh lý. Tuy nhiên bệnh tâm thần-tâm lý có thể làm tăng hô hấp đến mức dẫn đến tình trạng nhiễm kiềm.
Một type sinh lý của nhiễm kiềm hô hấp xảy ra khi một người lên độ cao lớn. Nồng độ O2 thấp kích thích hô hấp, gây mất CO2 dẫn đến kiềm hô hấp nhẹ. Giống như trên, cơ thể đáp ứng bù trừ nhờ hệ đệm dịch cơ thể và thận tăng bài tiết HCO3-.
Nhiễm toan chuyển hóa là do giảm nồng độ HCO3- dịch ngoại bào
Thuật ngữ nhiễm toan chuyển hóa được dùng cho tất cả các dạng nhiễm toan bên cạnh nguyên nhân do tăng CO2 trong dịch cơ thể. Toan chuyển hóa là kết quả của một số nguyên nhân tổng quát sau: thận giảm chức năng bài tiết acid hình thành trong cơ thể, cơ thể tạo ra quá nhiều acid trong trao đổi chất, uống hoặc tiêm truyền các chất có tính acid cho cơ thể, mất baso trong các dịch cơ thể, điều này có tác dụng giống như thêm acid cho cơ thể. Một số tình trạng cụ thể gây toan chuyển hóa sẽ được mô tả ở phần sau.
Nhiễm toan ống thận. Nhiễm toan ống thận là do khiếm khuyết trong bài tiết H+ hoặc tái hấp thu HCO3- hoặc cả hai. Những rối loạn này nhìn chung chia làm 2 type: (1) suy giảm tái hấp thu HCO3- ở ống thận làm mất HCO3- vào nước tiểu, (2) mất khả năng bài tiết H+ của ống thận, đây là cơ chế làm cho bình thường nước tiểu có tính acid, sự mất khả năng này làm kiềm nước tiểu. Hai rối loạn trên gây ra không đủ trung hòa acid cơ thể và giảm bài tiết NH4+, do đó gây ra tích lũy acid trong các dịch cơ thể. Một số nguyên nhân gây nhiễm toan ống thận gồm có suy thận mãn tính, bài tiết thiếu aldosterone (bệnh Addison), một số rối loạn di truyền dẫn đến suy giảm chức năng ống thận, chẳng hạn như hội chứng Fanconi (xem chương 32)
Tiêu chảy. Tiêu chảy là một trong những nguyên nhân thường xuyên nhất gây nhiễm toan chuyển hóa, nhiễm toan là do mất một lượng lớn Natribicarbonat vào phân. Dịch tiết đường tiêu hóa chứa nhiều bicarbonat, kết quả là tiêu chảy gây mất HCO3- của dịch cơ thể. ảnh hưởng này cũng tương tự như mất HCO3- vào nước tiểu. Đây là tình trạng toan chuyển hóa nghiêm trọng có thể dẫn đến tử vong, đặc biệt là trẻ em.
Nôn (các chất trong ruột). Nôn các chất trong dạ dày gây mất acid và có xu hướng gây nhiễm kiềm vì dịch tiết dạ dày có tính acid cao. Tuy nhiên, đôi khi xảy ra nôn một lượng lớn các chất trong ruột gây mất một lượng lớn bicarbonat gây ra nhiễm toan chuyển hóa giống như tiêu chảy.
Đái tháo đường. Đái tháo đường xảy ra do sự giảm bài tiết insulin của tuyến tụy (type 1) hoặc lượng insulin không đủ để bù đắp cho sự giảm nhạy cảm tác dụng của insulin (type 2). Trong trường hợp không đủ insulin dẫn đến cản trở sử dụng glucose trong trao đổi chất. Thay vào đó, các chất béo được cắt thành acid acetoacetic, các axit này được chuyển hóa bởi các mô sinh năng lượng. Với bệnh tiểu đường nặng, nồng độ acid acetoacetic máu tăng lên rất cao gây toan chuyển hóa nặng. Để bù trừ cho toan chuyển hóa nặng này, một lượng lớn acid được bài tiết vào nước tiểu, có thể lên tới 500mmol/ngày.
Uống acid. Hiếm khi có một lượng lớn acid trong thực phẩm bình thường. Tuy nhiên, đôi khi nhiễm toan chuyển hóa nặng là do uống một lượng lớn chất độc có tính acid.
Các chất này bao gồm acetylsalicylics (aspirin) và methyl alcohol (dạng chuyển hóa là acid formic).
Suy thận mạn tính. Khi chức năng thận suy giảm rõ rệt gây ra tích lũy anion của các acid yếu trong dịch cơ thể do không được đào thải qua thận. Ngoài ra, mức lọc cầu thận giảm gây ra giảm bài tiết phosphat và NH4+, giảm tái hấp thu HCO3- vào dịch cơ thể. Do đó suy thận mạn tính có thể gây ra toan chuyển hóa nặng.
Nhiễm kiềm chuyển hóa là do tăng nồng độ HCO3- dịch ngoại bào
Giữ quá mức HCO3- hoặc mất H+ trong cơ thể gây ra nhiễm kiềm chuyển hóa. Nhiễm kiềm chuyển hóa không phổ biến như toan chuyển hóa, nhưng phần sau đây sẽ mô tả một số nguyên nhân gây kiềm chuyển hóa.
Sử dụng thuốc lợi tiểu (trừ thuốc ức chế Carbonic Anhydrase)
Các thuốc lợi tiểu đều gây tăng lưu lượng dịch lọc dọc theo ống thận, điều đó làm tăng lưu lượng ở ống lượn xa và ống góp. Hiệu ứng này dẫn đến tăng tái hấp thu Na+ từ các phần của nephron. Vì sự tái hấp thu Na+ kèm theo bài tiết H+ nên sự tăng cường tái hấp thu Na+ dẫn đến tăng bài tiết H+ và tăng tái hấp thu bicarbonat. Những thay đổi này dẫn tới nhiễm kiềm, đặc trưng bởi tăng nồng độ HCO3- dịch ngoại bào.
Thừa aldosterone. Khi một lượng lớn Aldosterone được bài tiết bởi tuyến thượng thận sẽ gây ra nhiễm kiềm chuyển hóa nhẹ. Giống như bàn luận ở phần trên, aldosterone làm tăng tái hấp thu Na+ ở ống lượn xa và ống góp, đồng thời kích thích bài tiết H+ ở tế bào xen ống góp. Điều này làm tăng bài tiết H+ qua thận dẫn tới nhiễm kiềm.
Nôn (các chất ở dạ dày). Nôn các chất chỉ ở dạ dày, không liên quan tới các chất ở đường tiêu hóa dưới dạ dày, gây mất HCl do các tế bào niêm mạc dạ dày bài tiết. Kết quả là mất acid dịch ngoại bào dẫn tới nhiễm kiềm chuyển hóa. Nhiễm kiềm này thường xảy ra đặc biệt là ở trẻ sơ sinh có hẹp môn vị do phì đại cơ thắt.
Uống thuốc có tính kiềm. Một nguyên nhân phổ biến gây ra nhiễm kiềm chuyển hóa là uống thuốc có tính kiềm như natribicarbonate, để điều trị viêm dạ dày hoặc loét dạ dày tá tràng.
Điều trị nhiễm axit hoặc nhiễm kiềm
Cách điều trị tốt nhất cho nhiễm axit hoặc nhiễm kiềm là điều chỉnh lại tình trạng gây ra sự bất thường. Điều này thường rất khó, đặc biệt đối với các bệnh mạn tính làm suy yếu chức năng của phổi hoặc gây ra suy thận. Trong những trường hợp này, có nhiều chất khác nhau có thể được sử dụng để trung hòa lượng axit quá ngưỡng hoặc căn cứ vào chất lưu ngoại bào.
Để trung hòa lượng axit vượt ngưỡng, lượng lớn natri cacbonnat có thể được đưa vào bằng đường uống. Muối natri cacbonat được hấp thụ ở đường ruột vào máu và tăng lượng HCO3 – của hệ thống đệm bicarbonate, vì thế làm tăng pH gần đến bình thường. Natri cacbonat có thể được truyền tĩnh mạch nhưng vì có những tác động nguy hiểm tiềm ẩn của cách điều trị này, do đó mà các chất khác thường xuyên được sử dụng thay thế như natri lactat và natri gluconate. Lượng chất lactate và gluconate có trong cơ bắp được chuyển hóa trong cơ thể, để lại natri trong dịch ngoại bào dưới natri bicacbonat và vì thế làm tăng lên pH của dịch ngoại bào gần đến bình thường.
Đối với việc điều trị của chứng nhiễm kiềm, amoni clorua có thể được cung cấp bằng đường uống. Khi chất này được hấp thụ vào máu, lượng amoni được chuyển hóa ở gan thành urê. Phản ứng này giải phóng HCl,là chất sẽ ngay lập tức phản ứng hệ đệm của cơ thể để chuyển sự tập chung của H+ thành đặc tính của axit. Amoni clorua cũng có thể được truyền tĩnh mạch nhưng NH4 + rất độc hại và quá trình này có thể trở nên vô cùng nguy hiểm. Phương pháp trị liệu phù hợp nhất là đảo nghịch lại nguyên nhân cơ bản gây ra chứng nhiễm kiềm. Ví dụ nếu nhiễm kiềm chuyển hóa liên qun đến việc giảm thể tích dịch ngoại bào, nhưng tim không bị ảnh hưởng thì giải pháp truyền một lượng đầy đủ phù hợp huyết thanh nhân tạo thường có hiệu quả trong việc trị liệu chứng nhiễm kiềm.
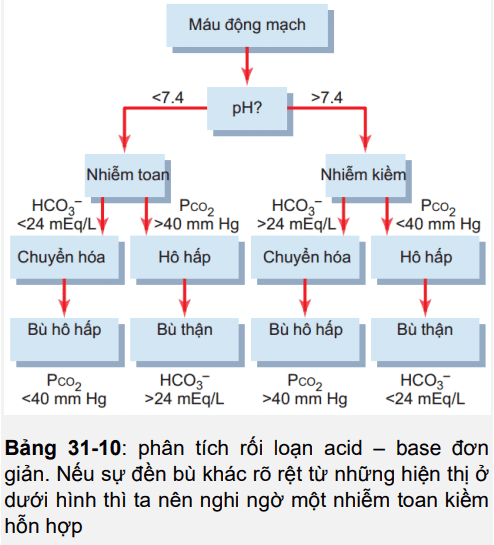
Hình 31-10
Các phương pháp và phân tích lâm sàng của nhiễm toan
Giả thiết phù hợp của rối loạn axit đòi hỏi phải có sự chẩn đoán chính xác. Rối loạn axit đơn giản được miêu tả trước đó có thể được chẩn đoán bằng việc phân tích ba phương pháp từ một mẫu máu : pH, HCO3 – huyết thanh, và PCO2.
Sự chẩn đoán này liên quan đến rất nhiều bước, được nói rõ ở bảng 31-10. Bằng việc kiểm tra độ pH, có thể biết được bệnh nhân bị rối loạn axit hay rối loạn kiềm. pH nhỏ hơn 7.4 cho thấy bệnh nhân nhiễm axit, trong khi pH lớn hơn 7.4 chỉ ra bệnh nhân nhiễm kiềm.
Bước thứ hai là phân tích PCO2 huyết tương và nồng độ HCO3 – . Giá trị bình thường của PCO2 vào khoảng 40 mm Hg và của HCO3 – là 24mEq/L. Nếu rối loạn được mô tả như là nhiễm toan và PCO2 huyết tương tăng lên thì phải có một thành phần đường hô hấp nhiễm toan. Sau khi bù bởi thận, nồng độ HCO3- huyết thanh ở đường hô hấp nhiễm toan sẽ có xu hướng tăng lên trên mức bình thường. Vì thế giá trị kì vọng cho một nhiễm toan hô hấp đơn giản sẽ giảm pH, tăng PCO2 và tăng nồng độ HCO3- huyết thanh sau mỗi lần bù bởi thận từng phần .
Đối với nhiễm toan chuyển hóa, sẽ có sự giảm PH huyết thanh. Tuy nhiên với nhiễm toan chuyển hóa thì sự bất bình thường đầu tiên là việc giảm nồng độ HCO3- huyết thanh. Vì thế nếu pH thấp tương tác với nồng độ HCO3- thấp thì phài có một thành phần chuyển hóa axit. Trong nhiễm toan chuyển hóa đơn thuần, lượng PCO2 giảm đi vì một phần bù đắp vào hô hấp, trái ngược với việc nhiễm toan hô hấp mà trong đó lượng PCO2 tăng lên. Vì thế, đối với việc toan chuyển hóa đơn giản, chúng ta thường mong tìm thấy hàm lượng độ pH thấp, nồng độ HCO3- thấp và sự giảm đi PCO2 sau mỗi lần bù đắp bởi hô hấp
Quá trình phân ra các loại nhiễm kiềm liên quan đến các bước cơ bản. Đầu tiên, nhiễm kiềm chỉ rằng có sự tăng lên của pH huyết thanh. Nếu sự tăng lên này tương tác với việc giảm PCO2 thì phải có một thành phần đường hô hấp nhiễm kiềm. Nếu sự tăng lên pH tương tác với sự tăng lên của HCO3- thì phải có một thành phần chuyển hóa sang kiềm. Vì thế trong nhiễm kiềm hô hấp đơn giản, chúng ta mong muốn tìm thấy sự tăng lên của pH, sự giảm đi của PCO2 và việc giảm nồng độ HCO3- trong huyết thanh. Trong nhiễm kiềm chuyển hóa, ta mong muốn thấy sự tăng lên pH, HCO3- và sự tăng lên của PCO2.
Rối loạn hệ acid-base và việc sử dụng đồ thị axit bazo trong việc chẩn đoán
Trong một vài trường hợp, rối loạn axit base không kèm theo phản ứng bù lại phù hợp. Khi tình huống này xảy ra, sự bất thường được phản ánh như một sự rối loạn hỗn hợp toan kiềm, điều này có nghĩa là sẽ có hai hoặc nhiều hơn những nguyên nhân căn bản gây ra sự rối loạn toan kiềm. Ví dụ, một bệnh nhân có độ pH thấp sẽ được phân loại acidotic .Nếu rối loạn là chuyển hóa trung gian, việc này cũng đi kèm với nồng độ HCO3 huyết tương thấp và sau khi có sự bù đắp bởi hô hấp thích hợp một lượng thấp PCO2. Tuy nhiên nếu độ pH thấp và nồng độ HCO3 huyết tương thấp liên quan với lượng PCO2 tăng lên thì tình trạng bệnh sẽ được cho là có một thành phần hô hấp bị nhiễm toan cũng như là một thành phần chuyển hóa. Vì thế chứng rối loạn này sẽ được phân loại là nhiễm toan hỗn hợp. Rối loạn này có thể xảy ra, ví dụ nếu một bệnh nhân bị thiếu hụt HCO3 cấp tính ở đường ruột do bệnh tiêu chảy gây ra( toan chuyển hóa ) và khí thũng ( toan hô hấp)
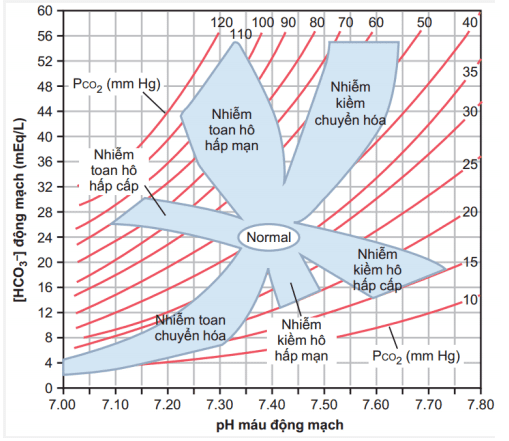
Hình 31-11
Một cách tiện lợi để chẩn đoán rối loạn axit bazo là sử dụng đồ thị axit bazo, như trên hình minh hoa 31 – 11. biểu đồ này có thể được sử dụng để xác định là nhiễm toan hay nhiễm kiềm, cũng như xác định mức độ nghiêm trọng của nó. Trong biểu đồ axit bazo này thì pH, nồng độ HCO3 và các giá trị PCO2 cắt nhau theo công thức Henderson – Hasselbalch. vòng tròn mở trung tâm cho thấy giá trị bình thường và sự sai lệch có thể vẫn được cân nhắc trong dãy thông thường. phần diện tích đổ bóng của biểu đồ cho thấy 95% giới hạn chắc chắn cho sự bù đắp thông thường đối với sự chuyển hòa bình thường và sự rối loạn hô hấp. Khi sử dụng đồ thị này, có thể cho rằng thời gian đủ trôi qua cho một phản ứng bù đắp là: bù đắp thông khí cho sự rối loạn chuyển hóa ban đầu là từ 6 đến 12 giờ và sự bù đắp chuyển hóa cho rối loạn hô hấp đầu tiên là 3 đến 5 ngày. nếu giá trị nằm trong vùng đổ bóng có nghĩa là có một sự rối loạn axit bazo đã diễn ra. ngược lại, nếu các giá trị của độ pH, bicarbonate hoặc PCO2 nằm ngoài vùng đổ bóng có nghĩa là bệnh nhân có thể đã nhiễm toan kiềm hỗn hợp.
Việc nhận ra một giá trị axit bazo nằm trong vùng đổ bóng không luôn luôn có nghĩa là một rối loạn axit diễn ra là rất quan trọng. Khi nhớ rõ lưu ý này thì biểu đồ axit cơ bản có thể được sử dụng như là công cụ nhanh chóng cho việc xác định các dạng cụ thể và mức độ nghiêm trọng của rối loạn acd-base.
Ví dụ, giả thiết rằng huyết thanh chính từ một bệnh nhân có các giá trị như sau: pH 7.30, sự tập trung huyết thanh HCO3 là 12 mEq/L và huyết thanh PCO2 là 25 mm Hg. với các giá trị này, chúng ta có thể nhìn vào biểu đồ và thấy rằng bệnh nhân nhiễm axit chuyển hóa đơn giản, với sự bù đắp hô hấp phù hợp để làm giảm lượng PCO2 từ giá trị bình thường 40 mm Hg xuống còn 25 mm Hg.
Một ví dụ thứ hai là một bệnh nhân với các chỉ số như sau: độ pH là 7.15, nồng độ HCO3 là 7 mEq/L, và PCO2 là 50 mm Hg. Trong ví dụ này, bệnh nhân bị nhiễm acidotic và có sự xuất hiện của một thành phẩn chuyển hóa vì nồng độ HCO3 thấp hơn giá trị thông thường là 24 mEq/L. tuy nhiên sự bù trừ bởi hô hấp mà thông thường làm giảm lượng PCO2 sẽ không còn nữa và lượng PCO2 sẽ tăng nhẹ, cao hơn gía trị bình thường ( giá trị bình thường là 40 mm Hg). Phát hiện này phù hợp với sự rối loạn axit bazo hỗn hợp bao gồm toan chuyển hóa cũng toan hô hấp.
Đồ thị axit bazo là một cách nhanh chóng để tiếp cận phân loại và đánh giá mức độ của rối loạn, một bệnh gây ra sự bất bình thường của pH, PCO2 và nồng độ bicarbonate. Trong các tài liệu ghi chép lâm sàng thì tiền sử bệnh nhân và các phát hiện vật lí khác cũng cung cấp những manh mối quan trọng liên quan gây ra và cách điều trị chứng rối loạn axit bazo.
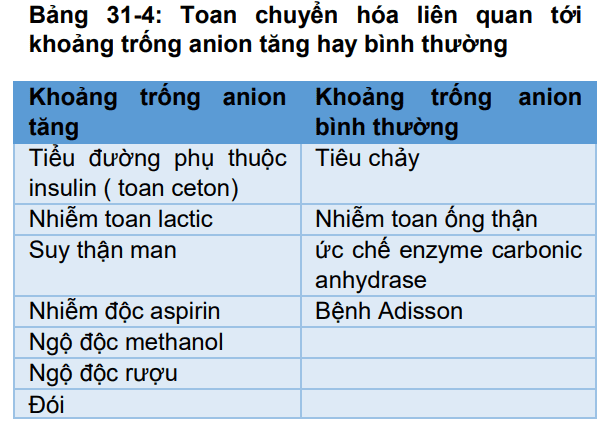
Bảng 31-4
Sử dụng khoảng trống anion để chấn đoán rối loạn acid-base Nồng độ các anion và cation trong huyết tương phải cân bằng để trung hòa về điện. Do đó, không có thực ― khoảng trống anion‖ trong huyết tương. Tuy nhiên chỉ có một số các cation và anion thường xuyên được đo trong lâm sàng và trong phòng thí nghiệm. Các cation thường được đo là Na + và anion thường được đo là Cl- và HCO3-. ― khoảng trống anion‖ ( chỉ là khái niệm chẩn đoán) là sự khác biệt giữa cation phụ và nồng độ phụ , được tính như sau: KT anion HT = Na+ – Cl- -HCO3- Khoảng trống anion tăng khi mà các anion phụ tăng hoặc các cation phụ giảm. Các cation không đo quan trọng nhất gồm canxi, magie và kali, các anion không đo quan trọng chủ yếu là albumin, photphat, sulphat và các anion hữu cơ khác. Thông thường anion phụ vượt quá các cation phụ và khoảng trống anion nằm trong khoảng từ 8 đến 16 mEq/l. Khoảng trống anion được sử dụng chủ yếu trong việc chẩn đoán các nguyên nhân khác nhau của nhiễm toan chuyển hóa. Trong nhiễm toan chuyển hóa, nồng độ HCO3- huyết tương giảm. Nếu nồng độ Na huyết tương không đổi , nồng độ anion ( Clhoặc anion phụ khác) phải tăng để duy trì cân bằng điện tích. Nếu Cl- huyết tương tăng tỉ lệ thuận với sự giảm HCO3- huyết tương thì khoảng trống anion không thay đổi. Điều này thường được gọi là hyperchloreimic toan chuyển hóa. Nếu HCO3- huyết tương giảm không kèm theo tăng Cl- thì phải có tăng nồng độ của các anion phụ và do đó khoảng trống anion tăng. Toan chuyển hóa do dư thừa acid (ngoài HCl) chẳng hạn như acid lactic hoặc ketoacid kết hợp với một khoảng trống anion huyết tương tăng do giảm HCO3- không tương xứng với mức độ tăng của Cl-. Một số ví dụ về toan chuyển hóa có khoảng trống anion bình thường hoặc tăng được trình bày ở bảng 31-4.
Bằng cách tính toán khoảng trống anion mà chúng ta có thể thu hẹp được một số nguyên nhân gây toan chuyển hóa.
Tài liệu tham khảo
Nguồn: Guyton and Hall textbook of Medical Physiology. Chapter 31: Acid-Base Regulation
 Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.
Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.