GIỚI THIỆU
Bất thường chuyển hóa lipid thường gặp ở những bệnh nhân bị bệnh thận. Tác dụng này nổi bật nhất trong hội chứng thận hư, do thường xảy ra sự tăng cao rõ rệt của cholesterol và triglycerid trong huyết thanh.
Bài viết này này sẽ xem xét cơ chế bệnh sinh và xử trí các bất thường lipid ở hội chứng thận hư. Cơ chế bệnh sinh và quản lý các bất thường lipid ở bệnh nhân bệnh thận mãn tính và sau ghép thận được thảo luận riêng.
CÁC VẤN ĐỀ THƯỜNG GẶP
Bệnh nhân mắc hội chứng thận hư thường có cholesterol toàn phần, lipoprotein cholesterol tỷ trọng thấp (low-density lipoprotein cholesterol – LDL-C), triglyceride và lipoprotein (a) tăng rõ rệt trong huyết tương [1,2]. Lipoprotein cholesterol tỷ trọng cao (high-density lipoprotein cholesterol – HDL-C) toàn phần thường bình thường hoặc thấp trong hội chứng thận hư, và thường giảm rõ rệt số lượng HDL2 có chức năng bảo vệ tim. Các nghiên cứu sau đây minh họa phạm vi phát hiện:
- Trong số 207 người trưởng thành mắc hội chứng thận hư do đái tháo đường (protein niệu trung bình 7,2 g / 24 h), trung bình cholesterol toàn phần 302 mg / dL (7,8 mmol / L), LDL-C trung bình 208 mg / dL (5,4 mmol / L), và nồng độ triglyceride trung bình là 251 mg / dL (2,8 mmol / L) [3]. Nồng độ HDL-C trung bình là 44 mg / dL (1,1 mmol / L).
- Một nghiên cứu khác trên 100 bệnh nhân mắc hội chứng thận hư cho thấy 87% cholesterol toàn phần trong huyết tương vượt quá 200 mg / dL (5,2 mmol / L), 53% quá 300 mg / dL (7,8 mmol / L) và 25% quá 400 mg / dL (10,3 mmol / L) [4]. Khoảng 77% bệnh nhân có mức LDL-C> 130 mg / dL (3,4 mmol / L) và 65% LDL-C> 160 mg / dL (4,1 mmol / L).
- Trong một nghiên cứu khác nữa trên 57 người trưởng thành mắc hội chứng thận hư, chức năng thận bình thường và không mắc các bệnh nền có liên quan (như đái tháo đường), mức triglyceride huyết thanh trung bình là 230 mg / dL (2,6 mmol / L) ở nam và 223 mg / dL (2,5 mmol / L) ở nữ [5].
Một số bệnh nhân mắc hội chứng thận hư có thể không có bất thường lipid. Ví dụ, mức cholesterol huyết thanh bình thường ở hội chứng thận hư đã được báo cáo ở những bệnh nhân thận hư có thoái hóa tinh bột ở thận và viêm thận lupus [6,7].
Nồng độ apolipoprotein huyết tương trong hội chứng thận hư phản ánh thay đổi chuyển hóa lipoprotein. Do đó, có mức tăng cao của apolipoprotein B (apoB), apoC-II và apoE, thuộc nhóm lipoprotein cholesterol tỷ trọng rất thấp (very-low-density lipoprotein cholesterol – VLDL-C) và LDL-C; mặt khác, mức độ của các lipoprotein chính của HDL-C, apo A-I và A-II, thường ở mức bình thường [5]. Chức năng của các apolipoprotein khác nhau được thảo luận riêng.
CƠ CHẾ BỆNH SINH
Về chuyển hóa LDL-C và cholesterol – bệnh nhân mắc hội chứng thận hư thường có sự gia tăng rõ rệt cholesterol toàn phần trong huyết thanh và LDL-C. Điều này là do sự kết hợp giữa tăng sinh tổng hợp và suy giảm dị hóa các lipoprotein có chứa apolipoprotein B (apoB) và cholesterol [5,8-11]. Một số cơ chế đã được chứng minh là góp phần gây ra những khiếm khuyết này trong chuyển hóa cholesterol ở bệnh nhân và động vật thí nghiệm mắc hội chứng thận hư, bao gồm các cơ chế sau (như hình)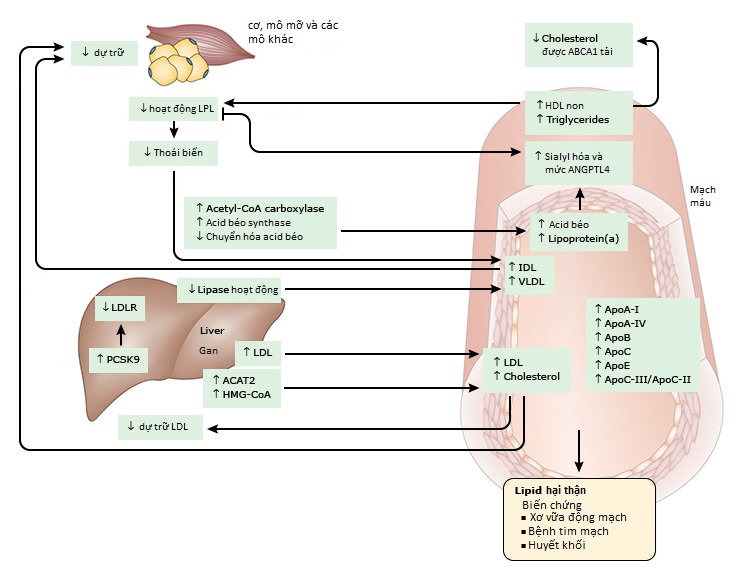
- Tăng hoạt động reductase 3-hydroxy-3-methylglutaryl-CoA (HMG-CoA) trong gan của động vật thận hư, dẫn đến tăng tổng hợp cholesterol [12,13].
- Hoạt động của acetyl CoA acetyltransferase 2 (ACAT2) ở gan tăng lên, hệ quả là tăng cường quá trình ester hóa cholesterol và giảm mức cholesterol tự do nội bào [9,14]. Trong các mô hình thực nghiệm, việc ức chế hoạt tính của ACAT đã được chứng minh là cải thiện lipid huyết thanh và protein niệu [9].
- Giảm hoạt động của lipase gan và giảm hoạt động của lipoprotein lipase (LPL) ở nội mô và các mô ngoại vi (như cơ và mô mỡ), dẫn đến giảm khả năng thoái biến lipoprotein [15-20].
- Tăng biểu hiện ở gan của proprotein convertase subtilisin / kexin type 9 (PCSK9), thúc đẩy thoái hóa thụ thể LDL và dẫn đến thiếu LDLR mắc phải và do đó, làm giảm thải LDL-C [21,22]. PCSK9 còn tăng hiện diện trong tế bào ống góp cũng đã được mô tả trong mô hình thực nghiệm về hội chứng thận hư, và sự thiếu hụt chọn lọc PCSK9 của ống góp trong mô hình này đủ để ngăn ngừa tăng cholesterol máu liên quan đến hội chứng thận hư [23].
Bệnh nhân mắc hội chứng thận hư có nồng độ PCSK9 trong huyết tương tăng cao tương ứng với mức protein niệu, HDL-C toàn phần và LDL-C toàn phần [24]. Ở một loạt bệnh nhân thận hư đã được cải thiện sau điều trị, giảm cholesterol huyết tương kèm theo giảm PCSK9 [25].
Thêm vào đó, mức lipoprotein (a) huyết tương tăng rõ ở những bệnh nhân có hội chứng thận hư so với người khỏe mạnh [3,26]. Việc tăng tổng hợp ở gan [27] và giảm dị hóa [28] đều có khả năng là nguyên nhân.
Về chuyển hóa HDL-C – Hội chứng thận hư dẫn đến những thay đổi đáng kể đối với cấu trúc và chức năng HDL-C. Bệnh nhân thận hư thường có HDL-C huyết tương bình thường hoặc giảm nhẹ [29]; tỷ lệ HDL-C trên tổng cholesterol thường giảm. Sự chuyển hóa HDL3 nghèo cholesterol ester thành HDL2 giàu cholesterol ester cũng giảm [30,31], giảm vận chuyển ngược cholesterol qua trung gian HDL-C. Một số cơ chế nghi ngờ gây nên những bất thường HDL-C này, gồm thiếu hụt lecithin-cholesterol acyltransferase (LCAT) mắc phải, giảm albumin máu, tăng nồng độ protein vận chuyển este cholesterol (CETP) trong huyết thanh và giảm thụ thể SR-B1 ở gan [1].
Một số thực nghiệm cho rằng sự suy giảm dòng cholesterol dư thừa từ nội bào đến các chất tiếp nhận ngoại bào tại thận có thể góp phần gây ra tiểu protein và làm bệnh nặng hơn trong một số bệnh rối loạn cầu thận [32,33].
Về chuyển hóa triglycerid – Bệnh nhân mắc hội chứng thận hư thường có nồng độ triglycerid huyết thanh, VLDL, IDL đều cao. Giảm chuyển hóa triglycerid mới là nguyên nhân chính gây tăng triglycerid máu do thận hư chứ không phải tăng tổng hợp (hình 1) [8,34-36]. Dòng goáng hóa VLDL được chuyển thành IDL và sau đó thành LDL-C bởi LPL bị chậm lại trong hội chứng thận hư [35]. Cũng có xu hướng giảm thanh thải LDL-C và IDL qua trung gian LDLR [11,35]. Hiện vẫn chưa hiểu chi tiết cách những thay đổi này xảy ra.
Sự gia tăng IDL và VLDL trong hội chứng thận hư chủ yếu là do hoạt động của LPL gặp trục trặc và giảm hoạt động của lipase gan [15]. Hoạt động LPL giảm được cho một phần do tăng tính thấm màng đáy cầu thận, mất các chất hoạt hóa LPL [37]. Đồng thời, lipase gan giảm hoạt động trong hội chứng thận hư cũng làm giảm độ thanh thải IDL và tăng triglycerid máu. Điều này có thể là hậu quả của tăng angiopoietin-like 4 (ANGPTL4) trong nỗ lực điều chỉnh tỉ lệ acid béo tự do / protein, vốn mất cân bằng nghiêm trọng do tiểu đạm[38].
Sự hấp thu acid béo và tích tụ triglyceride ở vỏ thận đã được chứng minh gây tổn thương cầu thận trên các mô hình thực nghiệm [39].
Cơ chế khác – đáp ứng tăng lipid máu được kích hoạt một phần do giảm áp suất keo, mức độ nghiêm trọng của tăng lipid máu sẽ tỷ lệ nghịch với giảm áp suất keo[5]. Tăng áp suất keo (do cơ thể tự điều chỉnh hay do thuốc) làm đảo ngược tình trạng tăng lipid máu [5,40].
Áp suất keo thấp trực tiếp kích thích quá trình phiên mã apoB ở gan [41]. Hơn nữa, ở môi trường in vivo, nâng áp lực keo bằng albumin hoặc dextran làm đảo ngược những thay đổi [41] và giảm nhanh mức lipid ở bệnh nhân thận hư [42]. Cơ chế tăng sản xuất lipoprotein khi giảm áp suất keo khá phức tạp vì kích thước lipoprotein quâ lớn so với albumin.
TÁC ĐỘNG TRÊN LÂM SÀNG
Có rất nhiều tài liệu cho rằng tăng cholesterol máu là một trong các yếu tố nguy cơ chính trong phát sinh xơ vữa động mạch (CVD) và một số bệnh tim mạch khác. Hơn nữa, giảm mức cholesterol có thể làm giảm tỷ lệ các biến cố mạch vành bằng cách ngăn chặn thoái hóa thành mạch và quan trọng hơn là ngăn ngừa tổn thương xơ vữa động mạch tiến triển.
Các nghiên cứu chứng minh những đặc điểm này trên bệnh nhân thận hư khá ít. Tuy nhiên, có vẻ những bệnh nhân thận hư kéo dài và tăng lipid máu có nguy cơ cao mắc xơ vữa động mạch và các bệnh tim mạch khác, đặc biệt nếu có thêm các yếu tố nguy cơ tim mạch [4,34,43]. Trong một nghiên cứu so sánh 142 bệnh nhân người lớn không mắc bệnh đái tháo đường có hội chứng thận hư với nhóm chứng tương ứng, những người mắc hội chứng thận hư có nguy cơ nhồi máu cơ tim cao hơn (nguy cơ tương đối [RR] 5,5, 95% CI 1,6-18,3) và nguy cơ tử vong do mạch vành cao hơn không đáng kể (RR 2,8, 95% CI 0,7-11,3) [43]. Các trường hợp nhồi máu cơ tim hiếm gặp ở trẻ em cũng đã được báo cáo trên nền hội chứng thận hư [44,45]. Vì vậy, liệu pháp hạ lipid máu tích cực để ngăn ngừa CVD có thể được đảm bảo ở những bệnh nhân mắc hội chứng thận hư mãn tính không thuyên giảm bệnh.
Các thực nghiệm ở động vật bị bệnh thận và một số ở người, đặc biệt là các phân tích hậu kiểm, cho thấy rằng tăng lipid máu cũng có thể làm tăng tổn thương thận do tác động trực tiếp lên tế bào gian mao mạch, màng lọc cầu thận và tế bào ống (được gọi là ” độc tính với lipid trong bệnh cầu thận” ) [2]. Điều này có thể tạo thành cơ sở lý luận bổ sung cho việc giảm nồng độ lipid ở bệnh nhân thận hư, mặc dù dữ liệu hiện có cho thấy liệu pháp statin không làm giảm nguy cơ biến cố suy thận ở người lớn không được lọc máu [46].
ĐÁNH GIÁ
Hiện không có chỉ dẫn thống nhất về thời điểm hoặc cách đánh giá tình trạng tăng lipid máu ở bệnh nhân mắc hội chứng thận hư. Chúng tôi lập bảng lipid lúc đói (bao gồm cholesterol toàn phần, LDL-C, HDL-C và triglyceride) ở tất cả bệnh nhân tại thời điểm phát hiện hội chứng thận hư. Nếu không phát hiện bất thường lipid nào, bảng lipid lúc đói sẽ được tái lập mỗi ba tháng một lần cho tới khi khỏi bệnh.
Do hội chứng thận hư có liên quan đến việc tăng nguy cơ mắc bệnh tim mạch hay CVD (xem phần Tác động trên lâm sàng’ ở trên), tất cả bệnh nhân mắc hội chứng thận hư phải được đánh giá nguy cơ mắc bệnh tương tự như dân số chung. Điều cần lưu ý là hầu hết các công cụ tính toán nguy cơ CVD thường được sử dụng chưa được kiểm chứng ở bệnh nhân dưới 40 tuổi và không bao gồm hội chứng thận hư như một yếu tố ảnh hưởng. Do đó, việc sử dụng công thức tính nguy cơ CVD có thể không đánh giá chính xác nguy cơ CVD ở bệnh nhân mắc hội chứng thận hư, đặc biệt là những người trẻ hơn hoặc không có các yếu tố nguy cơ CVD từ trước (như tăng huyết áp hoặc đái tháo đường). Cách tiếp cận để đánh giá rủi ro CVD ở người lớn và trẻ em được thảo luận riêng ở bài khác.
KIỂM SOÁT
Ở những bệnh nhân mắc hội chứng thận hư, việc kiểm soát lipid máu chủ yếu là gián tiếp thông qua việc điều trị hội chứng thận hư. Điều chỉnh lối sống (bao gồm chế độ ăn, tăng cường hoạt động thể chất và giảm cân) và liệu pháp hạ lipid máu có thể được chỉ định cho một số bệnh nhân, chẳng hạn như những người bị hội chứng thận hư kéo dài và vẫn tăng lipid máu mặc dù đã điều trị rối loạn thận cơ bản. Tuy nhiên, những hướng dẫn kiểm soát tối ưu tăng lipid máu ở nhóm bệnh nhân này còn hạn chế.
Điều trị hội chứng thận hư – phương pháp chính để điều trị các bất thường về lipid liên quan đến hội chứng thận hư là điều trị bệnh thận dẫn đến hội chứng thận hư. Các phác đồ như vậy có thể bao gồm thuốc ức chế miễn dịch và một số thuốc kết hợp, chẳng hạn như thuốc ức chế men chuyển (angiotensin-converting enzyme – ACE) hoặc thuốc chẹn thụ thể angiotensin (angiotensin receptor blocker – ARB). Tăng lipid máu được ghi nhận trong hội chứng thận hư thường tự khỏi khi bệnh thận được giải quyết. (Xem “Cơ chế bệnh sinh” ở trên.)
Việc giảm bài tiết protein khi dùng thuốc ức chế men chuyển hoặc ARB có thể dẫn đến giảm 10 – 20% nồng độ LDL-C và lipoprotein (a) trong huyết tương [47]. Mức độ của những thay đổi này dường như liên quan đến mức độ giảm bài tiết protein, nhưng chúng có thể xảy ra khi nồng độ albumin huyết tương tăng lên rất ít hoặc không.
Về lối sống – Tất cả bệnh nhân bị tăng cholesterol hoặc tăng triglycerid máu liên quan đến hội chứng thận hư nên được tư vấn về việc thay đổi lối sống, chẳng hạn như chế độ ăn uống có lợi cho tim mạch, tăng cường hoạt động thể chất, cai thuốc lá và giảm cân. Mặc dù hiệu quả của việc này chưa được nghiên cứu kỹ ở những bệnh nhân mắc hội chứng thận hư, nhưng chúng đã được chứng minh là có tác dụng trong ngăn ngừa mắc phải và tử vong do tim mạch trong dân số. Thay đổi lối sống là chỉ định đầu tay ở trẻ bị rối loạn lipid máu.
Không rõ liệu chế độ ăn hạn chế chất béo có lợi cho bệnh nhân tăng lipid máu liên quan đến hội chứng thận hư hay không. Trong một thử nghiệm ngẫu nhiên trên 20 bệnh nhân mắc hội chứng thận hư mãn tính được công bố vào năm 1993, việc sử dụng chế độ ăn đậu nành và thực vật với ít chất béo và protein, không có cholesterol và giàu acid béo không bão hòa đã làm giảm 25 đến 30% lipid [48]; tuy nhiên, những thay đổi này có thể do đến giảm protein niệu kèm theo.
Dùng thuốc
Tiếp cận – tất cả bệnh nhân mắc hội chứng thận hư nên được điều trị thích hợp tinh trạng tăng lipid máu để phòng ngừa bệnh tim mạch (CVD) dựa trên nguy cơ CVD đã đánh giá (sử dụng máy tính nguy cơ) và ước tính mức lọc cầu thận (estimated glomerular filtration rate – eGFR). Mặc dù việc sử dụng máy tính nguy cơ CVD chưa được xác nhận cụ thể ở những bệnh nhân mắc hội chứng thận hư, chúng tôi tin rằng việc sử dụng chúng cho hầu hết người lớn mắc hội chứng thận hư là hợp lý. Tuy nhiên, như đã lưu ý trước đây (xem phần ‘Đánh giá’ ở trên), các công cụ ước tính nguy cơ CVD có thể không đánh giá chính xác nguy cơ ở những bệnh nhân <40 tuổi hoặc những người không có yếu tố nguy cơ CVD từ trước (như tăng huyết áp hoặc đái tháo đường).
Ở những bệnh nhân mắc hội chứng thận hư không có khuyến cáo điều trị dự phòng CVD dựa trên nguy cơ CVD ước tính hoặc eGFR. Không có tiêu chí hiện có nào về ngưỡng lipid máu mà tại đó nên bắt đầu dùng thuốc và không có dữ liệu để hướng dẫn thời điểm hoặc mục tiêu tối ưu của việc dùng thuốc. Hơn nữa, cũng không có nghiên cứu nào chứng minh rằng việc giảm nồng độ lipid ở bệnh nhân hội chứng thận hư có giảm nguy cơ mắc các biến cố tim mạch. Do đó, việc dùng thuốc hạ lipid nên được xem xét trên cơ sở từng trường hợp sau khi cân nhắc giữa lợi ích và tác hại của việc điều trị. Cách tiếp cận chủ yếu dựa trên kinh nghiệm lâm sàng của chúng tôi, như sau:
Chúng tôi điều trị nguyên nhân gây ra hội chứng thận hư trước vì tăng lipid máu thường sẽ đảo ngược khi giải quyết hội chứng thận hư. (Xem phần ‘Điều trị hội chứng thận hư’ ở trên.)
- Nếu thận hư khỏi trong 3 – 6 tháng, chúng tôi không dùng thuốc hạ lipid trừ khi được thực sự cần thiết để phòng ngừa CVD dựa trên eGFR và nguy cơ CVDcủa bệnh nhân.
- Nếu hội chứng thận hư kéo dài hơn 6 tháng (thuật toán 1), chúng tôi đo lại bảng lipid lúc đói và bắt đầu dùng statin hạ lipid nếu LDL-C> 100 mg / dL (2,6 mmol / L ) hoặc để phòng ngừa CVD nếu cần thiết theo nguy cơ CVD ước tính của bệnh nhân và eGFR. Cách lựa chọn và liều lượng statin được thảo luận ở phần dưới. Hiếm bệnh nhân có LDL-C ≤100 mg / dL (2,6 mmol / L), riêng tăng triglyceride máu nghiêm trọng (ví dụ: triglyceride huyết thanh> 400 mg / dL), chúng tôi sử dụng acid béo omega-3 (như icosapent ethyl hoặc thực phẩm chức năng) hoặc fibrate.
Ở những bệnh nhân có hội chứng thận hư kéo dài, chúng tôi cũng sử dụng chỉ số LDL-C để đánh giá tình trạng lipid máu vì độ tin cậy CVD thấp vì không rõ nguy cơ CVD có được ước tính chuẩn bằng công thức dưới tác động của các thay đổi nội môi do thận hư ( xem phần ‘Đánh giá’ ở trên). Tuy nhiên, không có bằng chứng để xác định cách dùng LDL-C (hay chỉ số khác) trên nền thận hư có tương tự mức dùng cho người không thận hư đồng thời không có CVD nhưng có nguy cơ CVD cao.
Chúng tôi thường bắt đầu can thiệp lipid sau 3-6 tháng sau khi phát hiện thận hư, một số bác sĩ có thể chọn bắt đầu cho dùng thuốc sớm hơn hoặc muộn hơn trong quá trình điều trị. Chúng tôi cảm thấy rằng nên đợi đến sáu tháng để bắt đầu dùng thuốc khì chưa chắc chắn việc trì hoãn có ảnh hưởng đến tăng nguy cơ mắc bệnh tim mạch về sau ở những người này hay không.
Statin – chúng tôi khuyến cáo dùng statin như thuốc đầu tay để điều trị chứng tăng lipid máu ở những bệnh nhân mắc hội chứng thận hư, đây cũng la loại được ưa chuộng cho tình huống này:
- Liều lượng và hiệu quả – Có một số dược chất khác nhau trong nhóm Liều khởi đầu thường dựa trên tương tác thuốc, giá, tác dụng phụ và yêu cầu của bệnh nhân. Chúng tôi thường khởi đầu bằng liều statin trung bình (như atorvastatin 10 – 20 mg / ngày hoặc simvastatin 20 – 40 mg / ngày).
Ở những bệnh nhân bị tăng lipid máu do thận hư, statin có thể làm giảm 20 – 45% LDL-C trong huyết tương, tuy giảm ít hơn triglyceride [34,49-52]. Nồng độ lipoprotein (a) cũng có thể bị giảm, đặc biệt ở những bệnh nhân trị số cao [53]. Tuy nhiên, có rất ít dữ liệu về thời điểm có thể ngừng statin cũng như thới điểm thận hư không là nguy cơ CVD [52].
Một báo cáo đã gợi ý rằng statin có thể bảo vệ thận [54], một tác dụng có thể là trung gian dẫn đến cải thiện chức năng nội mô [55], nhưng phát hiện này đã không được đào sâu trong các nghiên cứu lớn hơn khác.
- Theo dõi và mục tiêu điều trị – Ở những bệnh nhân dùng statin, nên theo dõi lipid máu lúc đói từ 4 đến 12 tuần sau khi bắt đầu dùng statin hoặc điều chỉnh liều và cứ sau 3 đến 12 tháng để đánh giá đáp ứng và tuân thủ điều trị.
Mức LDL-C tối ưu ở bệnh nhân hội chứng thận hư vẫn chưa rõ. Chúng tôi chuẩn độ liều statin để đạt được mục tiêu LDL-C là <100 mg / dL (2,6 mmol / L) vì hội chứng thận hư tăng nguy cơ CVD. Dù vậy, không có bằng chứng nào chứng minh ngưỡng LDL-C này (hoặc bất kỳ ngưỡng nào khác) thích hợp với bệnh nhân hội chứng thận hư. Nếu không thể đạt được LDL-C mục tiêu với liều statin có thể dung nạp tối đa, cần phải sử dụng thêm các thuốc bậc hai. (Xem ‘Các thuốc bậc hai và các phương pháp khác’ bên dưới.)
- Thời gian điều trị – Nếu điều trị khỏi hội chứng thận hư, ngừng statin trừ khi liệu pháp hạ lipid được chỉ định để phòng ngừa CVD dựa trên nguy cơ CVD và eGFR của bệnh nhân. Nếu bệnh nhân có albumin niệu kéo dài hoặc eGFR của họ <60 mL / phút / 1,73 m2, chúng tôi tiếp tục vô thời hạn.
- Tác dụng không mong muốn – Các tác dụng phụ và vấn đề không dung nạp statin, sự khác biệt giữa các statin, được thảo luận riêng.
Thuốc bậc hai và các phương pháp khác – Một số bệnh nhân bị hội chứng thận hư kéo dài có thể không dung nạp statin hoặc không thể đạt mức LDL-C mong muốn mặc dù dùng liều statin tối đa có thể. Những người khác có khả năng đồng thời tăng triglyceride, không đáp ứng với statin. Đối với những bệnh nhân như vậy, một số phương pháp điều trị bậc hai, bao gồm ezetimibe, chất ức chế proprotein convertase subtilisin-kexin loại 9 (proprotein convertase subtilisin-kexin type 9 – PCSK9), fibrate, thuốc cô lập acid mật, acid nicotinic (niacin), omega-3 và hấp thu LDL . Hiệu quả của điều trị bậc hai có thể thay đổi, và việc sử dụng các thuốc này thường hạn chế vơi các tác dụng phụ [34,49,57]. Cách xử lý với điều trị bậc hai, dựa trên bằng chứng độ tin cậy khá thấp và kinh nghiệm lâm sàng của chúng tôi, như sau:
- Đối với những bệnh nhân có LDL-C ≥100 mg / dL (2,6 mmol / L) mặc dù liều statin tối đa, chúng tôi khuyến cáo kết hợp ezetimibe vì an toàn và ít tác dụng phụ hơn cả. Nếu vẫn không thể đạt được LDL-C mục tiêu khi dùng statin cùng với ezetimibe, thì thuốcức chế PCSK9 hoặc fibrate là sẽ là lựa chọn cho bậc điều trị thứ Giá cả, sử dụng qua đường tiêm và thiếu dữ liệu an toàn về lâu về dài với nhómức chế PCSK9 hạn chế việc sử dụng chúng.
- Đối với những bệnh nhân không thể dung nạp statin, chúng tôi đề xuất thuốcức chế PCSK9, fibrate hoặc thuốc cô lập acid mật. Như đã nêu ở trên, việc sử dụng chất ức chế PCSK9 có thể bị hạn chế bởi chi phí và yêu cầu khi tiêm. Các thuốc cô lập acid mật rẻ hơn đáng kể, nhưng việc sử dụng chúng thường bị hạn chế bởi tác dụng phụ trên đường tiêu hóa.
- Đối với bệnh nhân tăng triglycerid máu kéo dài và nghiêm trọng (ví dụ: triglycerid huyết thanh> 400 mg / dL) mặc dù dùng liều statin tối đa, chúng tôi khuyến cáo dùng fibrate.
Bằng chứng cho các liệu pháp điều trị thứ hai được trình bày dưới đây:
- Ezetimibe – Ezetimibe là thuốc giảm LDL-C được kê đơn phổ biến nhất sau statin. Nó cải thiện tình trạng mạch không nhiều, thường được sử dụng kết hợp với statin hoặc thay thế statinở những bệnh nhân không dung nạp statin. Hiện không có dữ liệu đánh giá việc sử dụng ezetimibe ở những bệnh nhân mắc hội chứng thận hư. Trong các thí nghiệm về hội chứng thận hư, ezetimibe có tác dụng cải thiện protein niệu và tích tụ triglycerid ở thận [39].
- Thuốc ức chế PCSK9 – Thuốc ức chế PCSK9 (ví dụ, evolocumab và alirocumab) có thể có lợi cho việc điều trị tăng lipid máu ở những bệnh nhân mắc hội chứng thận hư không dung nạp hoặc kháng statin, dựa trên các nghiên cứu chứng minh PCSK9 có thể tham gia vào cơ chế bệnh sinh của tăng cholesterol máu liên quan đến thận hư.
Trong một nghiên cứu trên 12 bệnh nhân mắc hội chứng thận hư và tăng cholesterol máu chưa kiểm soát được dù đã điều trị bằng statin, sử dụng thuốc ức chế PCSK9 làm giảm trung bình 37% nồng độ LDL-C sau bốn tuần mà không có thay đổi đáng kể về nồng độ albumin huyết thanh hoặc protein niệu [58]. Nồng độ trung bình PCSK9 trong huyết tương đã giảm từ mức 334 ng / mL lúc ban đầu xuống 190 ng / mL sau sáu tháng sau khi bắt đầu điều trị (khoảng 42%). Mặc dù những kết quả này rất đáng khích lệ, nhưng vẫn cần các nghiên cứu bổ sung để khẳng định.
- Fibrate – Fibrate, chẳng hạn như gemfibrozil, làm giảm mức cholesterol toàn phần từ 10% – 30% nhưng có liên quan đến tăng nguy cơ xuất hiện các vấn đề về cơ, đặc biệt nếu dùng chung với statin. Fibrate có tác dụng nổi bật hơn đối với triglyceride, làm giảm khoảng 50% nồng độ. Dữ liệu mô tả hiệu quả của chúng trên bệnh nhân hội chứng thận hư còn hạn chế [52,59,60].
- Thuốc cô lập acid mật – thuốc cô lập acid mật (colestipol và cholestyramine), với liều lượng 15 – 25 gam mỗi ngày, có thể làm giảm mức cholesterol toàn phần lên đến 30% khi dùng một mình [57] và có thể tương tác với statin cho tác dụng không mong muốn [50]. Tác dụng phụ trên đường tiêu hóa của các loại thuốc này thường khiến bệnh nhân không muốn dùng.
- Acid béo omega-3 – Việc bổ sung omega-3 ở những bệnh nhân mắc hội chứng thận hư hoặc protein niệu có thể làm giảm nồng độ triglyceride huyết thanh, với các tác động hỗn hợp lên mức LDL-C [62,63]. Những kết quả này cần được khẳng định trong các nghiên cứu lớn hơn.
- Loại bỏ LDL-C– phương pháp đã được sử dụng trong điều trị tăng cholesterol máu kháng thuốc. Một số nghiên cứu đã báo cáo về sự cải thiện các thông số protein niệu và lipid ở người lớn và trẻ em bị hội chứng thận hư có kháng glucocorticoid, những người được điều trị bằng phương pháp loại LDL có hoặc không có glucocorticoid đi kèm[64-66]. Các cơ chế có thể dẫn đến tác dụng này bao gồm loại bỏ các lipid độc hại, loại bỏ các kháng thể tự thân và các yếu tố thẩm thấu tiềm tàng, giảm các prostanoid gây co mạch và thromboxan A2, giảm các cytokine gây viêm [66]. Vai trò của phương pháp đắt tiền này trong điều trị bệnh nhân thận hư vẫn chưa chắc chắn vì khuyết thiếu các nghiên cứ kỹ hơn.
TỔNG KẾT VÀ KHUYẾN CÁO
- Ở bệnh nhân bệnh thận thường gặp chuyển hóa lipid bất thường. Tác dụng này nổi bật nhất tại hội chứng thận hư, nơi mà thường xảy ra việc cholesterol, LDL-C, triglyceride và lipoprotein (a) trong huyết tương tăng cao rõ rệt. Bệnh nhân có hội chứng thận hư kéo dài và tăng lipid máu có nguy cơ cao mắc bệnh tim mạch do xơ vữa động mạch, đặc biệt nếu có các yếu tố nguy cơ tim mạch khác.
- Cơ chế bệnh sinh – Đáp ứng tăng lipid máu được kích hoạt ít nhất một phần do giảm áp suất keo, kích thích phiên mã gen apoprotein B (apoB) ở gan. Quá trình dị hóa cũng có thể đóng một vai trò nào đó. Giảm thoái biến, chứ không phải tăng cường tổng hợp, là nguyên nhân chính gây tăng triglyceride máu trong thận hư. Giải quyết hội chứng thận hư làm đảo ngược tình trạng tăng lipid máu. (Xem ‘Sinh bệnh học’ ở trên.)
- Đánh giá – Không có hướng dẫn thống nhất về thời điểm hoặc cách thức đánh giá tình trạng tăng lipid máu ở bệnh nhân hội chứng thận hư. Chúng tôi lập bảng tổng hợp lipid lúc đói (bao gồm cholesterol toàn phần, LDL-C, HDL-C và triglyceride) ở tất cả bệnh nhân mắc hội chứng thận hư khi phát hiện bệnh. Tất cả bệnh nhân có hội chứng thận hư nên được đánh giá về tình trạng tăng lipid máu. (Xem phần ‘Đánh giá’ ở trên.)
- Xử trí – Ở những bệnh nhân mắc hội chứng thận hư, việc kiểm soát tăng lipid máu tập trung chủ yếu vào điều trị hội chứng thận hư. Điều chỉnh lối sống (bao gồm chế độ ăn uống, tăng cường hoạt động thể chất và giảm cân) và liệu pháp hạ lipid máu có thể được chỉ định cho một số bệnh nhân, chẳng hạn như những người bị hội chứng thận hư kéo dài và vẫn tăng lipid máu mặc dù đã điều trị rối loạn thận cơ bản. Tuy nhiên, bằng chứng để hướng dẫn phác đồ điều trị tăng lipid máu tối ưu ở nhóm bệnh nhân này còn hạn chế. (Xem ‘Điều trị hội chứng thận hư’ ở trên và ‘Thay đổi lối sống’ ở trên.)
Tất cả bệnh nhân mắc hội chứng thận hư nên điều trị tăng lipid máu để phòng ngừa CVD nếu thích hợp dựa trên nguy cơ CVD hoặc eGFR đã đánh giá.
Ở những bệnh nhân mắc hội chứng thận hư không có chỉ định điều trị dự phòng CVD, không chắc chắn cách xử lý tối ưu cho việc hạ lipid bằng thuốc. Không có tiêu chí hiện có nào về ngưỡng lipid máu mà tại đó nên bắt đầu điều trị bằng thuốc và không có dữ liệu để hướng dẫn thời điểm dừng thuốc hoặc mục tiêu cần đạt khi dùng thuốc. Cách tiếp cận của chúng tôi, chủ yếu dựa trên kinh nghiệm lâm sàng, như sau:
Điều trị nguyên nhân của hội chứng thận hư trước vì tăng lipid máu sẽ đảo ngược song song với việc giải quyết hội chứng thận hư. Nếu hội chứng thận hư khỏi trong vòng ba đến sáu tháng, không sử dụng thuốc hạ lipid trừ khi được chỉ định để phòng ngừa xơ vữa động mạch dựa trên nguy cơ xơ vữa động mạch và eGFR. Đối với những bệnh nhân có hội chứng thận hư không khỏi trong vòng ba đến sáu tháng và có LDL-C> 100 mg / dL (2,6 mmol / L), chúng tôi khuyến cáo nên bắt đầu hạ lipid bằng thuốc với sự lựa chọn đầu tay là statin. Đối với những bệnh nhân không thể dung nạp statin, có thể sử dụng thuốc ức chế PCSK9, fibrate hoặc thuốc cô lập acid mật. Ở một số ít bệnh nhân có LDL-C ≤100 mg / dL (2,6 mmol / L), chỉ riêng triglyceride máu tăng, chúng tôi điều trị bằng omega-3 (chẳng hạn như icosapent ethyl, nếu có, hoặc dầu cá) hoặc fibrate. (Xem ‘Tiếp cận’ và ‘Statin’ ở trên.)
Một số bệnh nhân bị hội chứng thận hư kéo dài có thể không dung nạp được statin hoặc không đạt được mục tiêu LDL-C mặc dù dùng statin với liều tối đa có thể. Đối với những bệnh nhân có LDL-C ≥100 mg / dL (2,6 mmol / L) bất chấp liều statin tối đa có thể, chúng tôi khuyến cáo nên thêm ezetimibe. Nếu vẫn không thể đạt được LDL-C mục tiêu với liều kết hợp statin và ezetimibe, thì chất ức chế PCSK9 hoặc fibrate là lựa chọn cho điều trị bậc ba. Đối với những bệnh nhân bị tăng triglycerid máu kéo dài và nghiêm trọng bất chấp liều statin tối đa có thể, chúng tôi khuyên bạn nên thêm fibrate vào phác đồ.
bài viết được dịch thuật và biên tập bởi ykhoa.org – vui lòng không reup khi chưa được cho phép
cập nhật đến 9/7/2021
Tài liệu tham khảo
- Vaziri ND. Disorders of lipid metabolism in nephrotic syndrome: mechanisms and consequences. Kidney Int 2016; 90:41.
- Agrawal S, Zaritsky JJ, Fornoni A, Smoyer WE. Dyslipidaemia in nephrotic syndrome: mechanisms and treatment. Nat Rev Nephrol 2018; 14:57.
- Kronenberg F, Lingenhel A, Lhotta K, et al. Lipoprotein(a)- and low-density lipoprotein-derived cholesterol in nephrotic syndrome: Impact on lipid-lowering therapy? Kidney Int 2004; 66:348.
- Radhakrishnan J, Appel AS, Valeri A, Appel GB. The nephrotic syndrome, lipids, and risk factors for cardiovascular disease. Am J Kidney Dis 1993; 22:135.
- Joven J, Villabona C, Vilella E, et al. Abnormalities of lipoprotein metabolism in patients with the nephrotic syndrome. N Engl J Med 1990; 323:579.
- HEPTINSTALL RH, JOEKES AM. Renal amyloid. A report on eleven cases proven by renal biopsy. Ann Rheum Dis 1960; 19:126.
- SHEARN MA. NORMOCHOLESTEROLEMIC NEPHROTIC SYNDROME OF SYSTEMIC LUPUS ERYTHEMATOSUS. Am J Med 1964; 36:250.
- Appel G. Lipid abnormalities in renal disease. Kidney Int 1991; 39:169.
- Vaziri ND, Liang KH. Acyl-coenzyme A:cholesterol acyltransferase inhibition ameliorates proteinuria, hyperlipidemia, lecithin-cholesterol acyltransferase, SRB-1, and low-denisty lipoprotein receptor deficiencies in nephrotic syndrome. Circulation 2004; 110:419.
- Demant T, Mathes C, Gütlich K, et al. A simultaneous study of the metabolism of apolipoprotein B and albumin in nephrotic patients. Kidney Int 1998; 54:2064.
- Vega GL, Toto RD, Grundy SM. Metabolism of low density lipoproteins in nephrotic dyslipidemia: comparison of hypercholesterolemia alone and combined hyperlipidemia. Kidney Int 1995; 47:579.
- Vaziri ND, Sato T, Liang K. Molecular mechanisms of altered cholesterol metabolism in rats with spontaneous focal glomerulosclerosis. Kidney Int 2003; 63:1756.
- Vaziri ND, Liang KH. Hepatic HMG-CoA reductase gene expression during the course of puromycin-induced nephrosis. Kidney Int 1995; 48:1979.
- Vaziri ND, Liang K. Up-regulation of acyl-coenzyme A:cholesterol acyltransferase (ACAT) in nephrotic syndrome. Kidney Int 2002; 61:1769.
- Garber DW, Gottlieb BA, Marsh JB, Sparks CE. Catabolism of very low density lipoproteins in experimental nephrosis. J Clin Invest 1984; 74:1375.
- Kaysen GA, Mehendru L, Pan XM, Staprans I. Both peripheral chylomicron catabolism and hepatic uptake of remnants are defective in nephrosis. Am J Physiol 1992; 263:F335.
- Levy E, Ziv E, Bar-On H, Shafrir E. Experimental nephrotic syndrome: removal and tissue distribution of chylomicrons and very-low-density lipoproteins of normal and nephrotic origin. Biochim Biophys Acta 1990; 1043:259.
- Sato T, Liang K, Vaziri ND. Down-regulation of lipoprotein lipase and VLDL receptor in rats with focal glomerulosclerosis. Kidney Int 2002; 61:157.
- Liang K, Vaziri ND. Gene expression of lipoprotein lipase in experimental nephrosis. J Lab Clin Med 1997; 130:387.
- Vaziri ND, Yuan J, Ni Z, et al. Lipoprotein lipase deficiency in chronic kidney disease is accompanied by down-regulation of endothelial GPIHBP1 expression. Clin Exp Nephrol 2012; 16:238.
- Liu S, Vaziri ND. Role of PCSK9 and IDOL in the pathogenesis of acquired LDL receptor deficiency and hypercholesterolemia in nephrotic syndrome. Nephrol Dial Transplant 2014; 29:538.
- Jin K, Park BS, Kim YW, Vaziri ND. Plasma PCSK9 in nephrotic syndrome and in peritoneal dialysis: a cross-sectional study. Am J Kidney Dis 2014; 63:584.
- Molina-Jijon E, Gambut S, Macé C, et al. Secretion of the epithelial sodium channel chaperone PCSK9 from the cortical collecting duct links sodium retention with hypercholesterolemia in nephrotic syndrome. Kidney Int 2020; 98:1449.
- Kwakernaak AJ, Lambert G, Slagman MC, et al. Proprotein convertase subtilisin-kexin type 9 is elevated in proteinuric subjects: relationship with lipoprotein response to antiproteinuric treatment. Atherosclerosis 2013; 226:459.
- Haas ME, Levenson AE, Sun X, et al. The Role of Proprotein Convertase Subtilisin/Kexin Type 9 in Nephrotic Syndrome-Associated Hypercholesterolemia. Circulation 2016; 134:61.
- Wanner C, Rader D, Bartens W, et al. Elevated plasma lipoprotein(a) in patients with the nephrotic syndrome. Ann Intern Med 1993; 119:263.
- Stenvinkel P, Berglund L, Ericsson S, et al. Low-density lipoprotein metabolism and its association to plasma lipoprotein(a) in the nephrotic syndrome. Eur J Clin Invest 1997; 27:169.
- Kaysen GA, Hoye E, Jones H Jr. Apolipoprotein AI levels are increased in part as a consequence of reduced catabolism in nephrotic rats. Am J Physiol 1995; 268:F532.
- Vaziri ND. HDL abnormalities in nephrotic syndrome and chronic kidney disease. Nat Rev Nephrol 2016; 12:37.
- Gherardi E, Rota E, Calandra S, et al. Relationship among the concentrations of serum lipoproteins and changes in their chemical composition in patients with untreated nephrotic syndrome. Eur J Clin Invest 1977; 7:563.
- Muls E, Rosseneu M, Daneels R, et al. Lipoprotein distribution and composition in the human nephrotic syndrome. Atherosclerosis 1985; 54:225.
- Pedigo CE, Ducasa GM, Leclercq F, et al. Local TNF causes NFATc1-dependent cholesterol-mediated podocyte injury. J Clin Invest 2016; 126:3336.
- Ducasa GM, Mitrofanova A, Mallela SK, et al. ATP-binding cassette A1 deficiency causes cardiolipin-driven mitochondrial dysfunction in podocytes. J Clin Invest 2019; 129:3387.
- Wheeler DC, Bernard DB. Lipid abnormalities in the nephrotic syndrome: causes, consequences, and treatment. Am J Kidney Dis 1994; 23:331.
- Warwick GL, Packard CJ, Demant T, et al. Metabolism of apolipoprotein B-containing lipoproteins in subjects with nephrotic-range proteinuria. Kidney Int 1991; 40:129.
- Shearer GC, Stevenson FT, Atkinson DN, et al. Hypoalbuminemia and proteinuria contribute separately to reduced lipoprotein catabolism in the nephrotic syndrome. Kidney Int 2001; 59:179.
- Moorhead JF, Chan MK, El-Nahas M, Varghese Z. Lipid nephrotoxicity in chronic progressive glomerular and tubulo-interstitial disease. Lancet 1982; 2:1309.
- Clement LC, Macé C, Avila-Casado C, et al. Circulating angiopoietin-like 4 links proteinuria with hypertriglyceridemia in nephrotic syndrome. Nat Med 2014; 20:37.
- Kim JJ, David JM, Wilbon SS, et al. Discoidin domain receptor 1 activation links extracellular matrix to podocyte lipotoxicity in Alport syndrome. EBioMedicine 2021; 63:103162.
- Stenvinkel P, Berglund L, Heimbürger O, et al. Lipoprotein(a) in nephrotic syndrome. Kidney Int 1993; 44:1116.
- Yamauchi A, Fukuhara Y, Yamamoto S, et al. Oncotic pressure regulates gene transcriptions of albumin and apolipoprotein B in cultured rat hepatoma cells. Am J Physiol 1992; 263:C397.
- BAXTER JH, GOODMAN HC, ALLEN JC. Effects of infusions of serum albumin on serum lipids and lipoproteins in nephrosis. J Clin Invest 1961; 40:490.
- Ordoñez JD, Hiatt RA, Killebrew EJ, Fireman BH. The increased risk of coronary heart disease associated with nephrotic syndrome. Kidney Int 1993; 44:638.
- Suryawanshi SP, Das B, Patnaik AN. Myocardial infarction in children: Two interesting cases. Ann Pediatr Cardiol 2011; 4:81.
- Silva JM, Oliveira EA, Marino VS, et al. Premature acute myocardial infarction in a child with nephrotic syndrome. Pediatr Nephrol 2002; 17:169.
- Su X, Zhang L, Lv J, et al. Effect of Statins on Kidney Disease Outcomes: A Systematic Review and Meta-analysis. Am J Kidney Dis 2016; 67:881.
- Keilani T, Schlueter WA, Levin ML, Batlle DC. Improvement of lipid abnormalities associated with proteinuria using fosinopril, an angiotensin-converting enzyme inhibitor. Ann Intern Med 1993; 118:246.
- D’Amico G, Gentile MG, Manna G, et al. Effect of vegetarian soy diet on hyperlipidaemia in nephrotic syndrome. Lancet 1992; 339:1131.
- Massy ZA, Ma JZ, Louis TA, Kasiske BL. Lipid-lowering therapy in patients with renal disease. Kidney Int 1995; 48:188.
- Rabelink AJ, Hené RJ, Erkelens DW, et al. Effects of simvastatin and cholestyramine on lipoprotein profile in hyperlipidaemia of nephrotic syndrome. Lancet 1988; 2:1335.
- Thomas ME, Harris KP, Ramaswamy C, et al. Simvastatin therapy for hypercholesterolemic patients with nephrotic syndrome or significant proteinuria. Kidney Int 1993; 44:1124.
- Kong X, Yuan H, Fan J, et al. Lipid-lowering agents for nephrotic syndrome. Cochrane Database Syst Rev 2013; :CD005425.
- Brown CD, Azrolan N, Thomas L, et al. Reduction of lipoprotein(a) following treatment with lovastatin in patients with unremitting nephrotic syndrome. Am J Kidney Dis 1995; 26:170.
- Bianchi S, Bigazzi R, Caiazza A, Campese VM. A controlled, prospective study of the effects of atorvastatin on proteinuria and progression of kidney disease. Am J Kidney Dis 2003; 41:565.
- Dogra GK, Watts GF, Herrmann S, et al. Statin therapy improves brachial artery endothelial function in nephrotic syndrome. Kidney Int 2002; 62:550.
- Migliozzi DR, Asal NJ. Clinical Controversy in Transplantation: Tacrolimus Versus Cyclosporine in Statin Drug Interactions. Ann Pharmacother 2020; 54:171.
- Valeri A, Gelfand J, Blum C, Appel GB. Treatment of the hyperlipidemia of the nephrotic syndrome: a controlled trial. Am J Kidney Dis 1986; 8:388.
- Jatem E, Lima J, Montoro B, et al. Efficacy and Safety of PCSK9 Inhibitors in Hypercholesterolemia Associated With Refractory Nephrotic Syndrome. Kidney Int Rep 2021; 6:101.
- Groggel GC, Cheung AK, Ellis-Benigni K, Wilson DE. Treatment of nephrotic hyperlipoproteinemia with gemfibrozil. Kidney Int 1989; 36:266.
- Büyükçelik M, Anarat A, Bayazit AK, et al. The effects of gemfibrozil on hyperlipidemia in children with persistent nephrotic syndrome. Turk J Pediatr 2002; 44:40.
- Ix JH, Isakova T, Larive B, et al. Effects of Nicotinamide and Lanthanum Carbonate on Serum Phosphate and Fibroblast Growth Factor-23 in CKD: The COMBINE Trial. J Am Soc Nephrol 2019; 30:1096.
- Bell S, Cooney J, Packard CJ, et al. The effect of omega-3 fatty acids on the atherogenic lipoprotein phenotype in patients with nephrotic range proteinuria. Clin Nephrol 2012; 77:445.
- Hall AV, Parbtani A, Clark WF, et al. Omega-3 fatty acid supplementation in primary nephrotic syndrome: effects on plasma lipids and coagulopathy. J Am Soc Nephrol 1992; 3:1321.
- Muso E, Mune M, Fujii Y, et al. Low density lipoprotein apheresis therapy for steroid-resistant nephrotic syndrome. Kansai-FGS-Apheresis Treatment (K-FLAT) Study Group. Kidney Int Suppl 1999; 71:S122.
- Hattori M, Chikamoto H, Akioka Y, et al. A combined low-density lipoprotein apheresis and prednisone therapy for steroid-resistant primary focal segmental glomerulosclerosis in children. Am J Kidney Dis 2003; 42:1121.
- Raina R, Krishnappa V. An update on LDL apheresis for nephrotic syndrome. Pediatr Nephrol 2019; 34:1655.
nguồn https://www.uptodate.com/contents/lipid-abnormalities-in-nephrotic-syndrome
 Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.
Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.