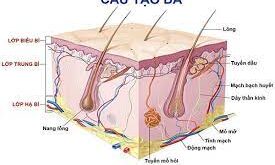
1. Mở đầu Chủng mới của virus corona (COVID-19), do virus corona 2 (SARS-CoV-2) gây ra hội chứng hô hấp cấp tính nghiêm trọng, đã lây lan cho hơn 2.3 triệu người, cướp đi hơn 160.000 mạng sống của 200 quốc gia. Mặc dù COVID-19 có thể không có triệu chứng, nhưng biểu hiện chủ yếu ở những bệnh nhân có triệu chứng là viêm phổi do virus, đôi khi phức tạp do hội chứng suy hô hấp cấp tính và / hoặc nhiễm trùng huyết. Ngoài ra, còn có thể có viêm cơ tim và tổn thương thận cấp. Ngược lại, các triệu chứng nội tiết vẫn chưa được báo cáo ở bệnh nhân COVID-19. Cơ chế bệnh sinh của COVID-19 bao gồm sự xâm nhập của SARS-CoV-2 qua hệ thống hô hấp và đọng lại trong nhu mô phổi. Sau đó, nó sử dụng enzym chuyển đổi angiotensin 2 (ACE2) như một thụ thể để xâm nhập vào các tế bào phổi của vật chủ. Ngoài ra, axit ribonucleic của virus (RNA) cũng đã được phát hiện trong huyết tương hoặc huyết thanh của bệnh nhân COVID-19, gợi ý về nhiễm virus huyết. Có nghĩa rằng ngoài tế bào phổi, virus có thể tự do tương tác với ACE2 trong các mô khác. Trên thực tế, có một số cơ quan nội tiết tiết ACE2, cụ thể là tuyến tụy, tuyến giáp, tinh hoàn, buồng trứng, tuyến thượng thận và tuyến yên. Mặc dù người ta nghĩ rằng sẽ có phản ứng nội tiết là hậu quả tương tác của SARS-CoV-2 với ACE2 trên các cơ quan này, nhưng vẫn chưa có dữ liệu lâm sàng / tiền lâm sàng. Tuy nhiên, dựa trên những quan sát được rút ra một phần từ các nghiên cứu liên quan đến đợt bùng phát SARS trước đó (năm 2003) và một phần từ các mô hình động vật, chúng tôi muốn khám phá những tác động có thể có của COVID-19 đối với hệ thống nội tiết.
- COVID-19 và tuyến tụy
ACE2 được tiết ra ở tuyến tụy với mức mRNA ở tuyến tụy cao hơn ở phổi. Nó được tiết ra bởi cả tuyến tụy ngoại tiết và tiểu đảo. Tổn thương tuyến tụy ngoại tiết biểu hiện bằng sự tăng amylase huyết thanh và / hoặc lipase tương ứng ở 1–2% và 17% bệnh nhân bị COVID-19 không nặng và nặng. Mặc dù tăng đường huyết phản ứng do stress có thể liên quan đến bất kì bệnh lý nghiêm trong nào, Yang et al. đã báo cáo rằng những bệnh nhân bị SARS (do SARS-CoV, “anh em họ” của SARS-CoV-2) chưa bao giờ dùng glucocorticoid, có đường huyết đói cao hơn đáng kể so với những bệnh nhân bị viêm phổi không do SARS. Trong một nghiên cứu khác, tổn thương qua trung gian SARS-CoV của tế bào β tuyến tụy được cho là cơ chế hợp lý đằng sau sự phát triển của bệnh ‘đái tháo đường cấp tính’ ở bệnh nhân SARS. Trên thực tế, hóa mô miễn dịch và lai tại chỗ đã xác định được SARS-CoV trong tuyến tụy của những bệnh nhân đã tử vong vì SARS. Do đó, mặc dù coronavirus không có trong các loại virus có liên quan đến bệnh sinh của đái tháo đường típ 1, SARS-CoV (và có lẽ cả SARS-CoV-2) có thể là tác nhân môi trường tiềm năng để phát triển của đái tháo đường típ 1. Ngoại trừ tổn thương tế bào β trực tiếp, sự thay đổi tự kháng nguyên và theo sau là sự phá hủy tế bào β qua miễn dịch trung gian cũng có thể liên quan . Ngoài ra, nhiễm trùng xung quanh tuyến tụy ngoại tiết bởi SARS-CoV và SARS-CoV-2 có thể gây chết tế bào bystander β thông qua giải phóng các chất trung gian như yếu tố hoại tử khối u α (TNFα) và interferon-γ. Một môi trường tiền viêm toàn thân được thể hiện rõ bởi một lượng lớn interleukin-1β, hóa ứng động bạch cầu mono (MCP-1), protein-10 cảm ứng bạch cầu. Ngay cả ở những bệnh nhân COVID-19 mức độ nhẹ, môi trường tiền viêm toàn thân cũng có thể đóng một vai trò trong việc làm trầm trọng thêm tình trạng bệnh. COVID-19 cũng có thể dẫn đến tình trạng kháng insulin nặng hơn ở những bệnh nhân mắc đái tháo đường típ 2 từ trước. Ngoài việc tạo ra nhiều cytokine, SARS-CoV còn làm tăng nồng độ fetuin A trong huyết thanh, một glycoprotein liên quan đến việc suy giảm độ nhạy insulin. Lopinavir – ritonavir được sử dụng để điều trị COVID-19 có thể gây rối loạn phân bố mỡ và kháng insulin sau đó. Hơn thế nữa, COVID-19 có liên quan đến hạ kali máu; điều này được cho là do giảm điều hòa ACE2 ở phổi, giảm thoái giáng angiotension-II và tăng tiết aldosterone. Hạ kali máu khiến việc kiểm soát đường huyết khó khăn hơn ở những bệnh nhân có đái tháo đường típ 1 và đái tháo đường típ 2 từ trước. Đái tháo đường ở bệnh nhân COVID-19 kèm bệnh nặng, hội chứng suy hô hấp cấp tính (ARDS) làm tăng tỷ lệ tử vong. Nguyên nhân có thể bao gồm suy giảm miễn dịch bẩm sinh và giảm mức ACE2 ở những người mắc bệnh đái tháo đường. Ngoài ra, nồng độ huyết thanh của các marker sinh học liên quan đến viêm (interleukin-6, ferritin huyết thanh, protein phản ứng C) và chỉ số đông máu (D-dimer) cao hơn ở bệnh nhân COVID-19 mắc đái tháo đường tiềm tàng so với những người không mắc, gợi ý những người bị đái tháo đường dễ bị ảnh hưởng bởi cơn bão cytokine, cuối cùng dẫn đến ARDS và tình trạng xấu đi nhanh chóng. Cho đến nay, các nghiên cứu không phân biệt giữa đái tháo đường típ 1 và đái tháo đường típ 2, dường như các nguy cơ liên quan đến COVID-19 ảnh hưởng đến cả hai thể bệnh. Tuy nhiên, những người mắc bệnh đái tháo đường (típ 1 và típ 2) bắt buộc phải có các biện pháp phòng ngừa bổ sung, thực hiện nghiêm ngặt cách ly xã hội và vệ sinh tay trong bối cảnh đại dịch này. Ngoài ra, cần đảm bảo kiểm soát tốt đường huyết. Một số loại thuốc đái tháo đường như pioglitazone (thông qua hoạt hóa thụ thể PPAR gamma) và liraglutide (thông qua hoạt hóa thụ thể GLP-1) đã được chứng minh là có thể tăng khả năng điều chỉnh mức ACE2 ở động vật. Tuy nhiên, bằng chứng hiện tại không ủng hộ thay đổi thuốc đang sử dụng. Tương tự như vậy, các tổ chức quốc tế khuyến cáo bệnh nhân sử dụng ACEi / ARBs nên tiếp tục uống. Béo phì cũng được phát hiện có liên quan đến bệnh nặng do COVID-19. Mô mỡ tiết ra ACE2; mô mỡ càng nhiều, tiết ACE2 càng nhiều và sẽ đóng vai trò như thụ thể đối với SARS-CoV-2. Như trong đái tháo đường, ngay cả lúc bình thường, bệnh nhân béo phì có nồng độ cytokine tiền viêm cao hơn như TNFα, IL-6 và MCP-1, được sản xuất bởi nội tạng và mô mỡ dưới da. Điều này dẫn đến phản ứng cytokin quá mức của bệnh nhân béo phì bị SARS-CoV-2, hậu quả là bị bệnh nặng và ARDS. Ngoài ra, béo phì cũng có liên quan đến suy giáp cận lâm sàng và suy sinh dục chức năng, ít nhất một phần có liên quan đến cytokine. Tình trạng này có thể trở nên trầm trọng hơn trong môi trường tiền viêm do COVID-19 gây ra.
- COVID – 19 và hệ sinh dục
ACE2 được tiết ra nhiều bởi tinh hoàn; trên thực tế, sự sản xuất mRNA và protein của ACE2 trong tinh hoàn gần như cao nhất trong cơ thể người. Hơn nữa, tế bào Leydig, tế bào Sertoli và tế bào sinh tinh đều tiết ACE2. Tuy nhiên, nồng độ testosterone huyết thanh trong COVID-19 cần được giải thích một cách thận trọng, vì bất kỳ bệnh nguy kịch cấp tính nào cũng có thể dẫn đến ức chế trục dưới đồi – tuyến yên – tinh hoàn, sinh hóa cho thấy hormone hoàng thể (LH), hormone kích thích nang trứng (FSH) và testosterone đều thấp. Tuy nhiên, một nghiên cứu gần đây ở 81 nam giới mắc COVID-19 cho thấy tổng lượng testosterone (T) trong huyết thanh thấp hơn (mặc dù không có ý nghĩa thống kê), trong khi LH huyết thanh cao hơn đáng kể so với 100 nam giới khỏe mạnh cùng độ tuổi. LH huyết thanh cũng thấp hơn đáng kể ở bệnh nhân COVID-19 và có ảnh hưởng xấu tới mức độ trầm trọng của bệnh. LH huyết thanh tăng cao ở nam giới bị COVID-19 phủ nhận khả năng ức chế trục dưới đồi – tuyến yên – tinh hoàn và gợi ý tổn thương tế bào Leydig nguyên phát. Theo quan sát này, viêm tinh hoàn là một biến chứng đã biết của SARS. Ngoài ra, SARS-CoV được chứng minh là làm giảm đáng kể testosterone huyết thanh ở chuột đực. Tuy nhiên, dữ liệu về chức năng hệ sinh dục ở phụ nữ bị COVID-19 (hoặc SARS) không có.
- COVID-19 và tuyến thượng thận
Một trong những khả năng xâm lấn hệ miễn dịch của SARS-CoV, giống như virus cúm, là loại bỏ khả năng chống stress của cortisol của vật chủ. Một giả thuyết rất thú vị là sự biểu hiện của một số trình tự axit amin nhất định của SARS-CoV bắt chước phân tử của hormone vỏ thượng thận vật chủ (ACTH). Hình thức bắt chước phân tử này thực sự có thể làm giảm sự gia tăng cortisol do stress gây ra, vì các kháng thể được tạo ra chống lại các phần tử virus sẽ vô tình phá hủy ACTH đang lưu hành. Thực tế là hầu hết các protein SARS-CoV-2 có độ tương đồng cao (95-100%) với các protein của SARS-CoV ban đầu khiến chúng ta tự hỏi liệu SARS-CoV-2 có thể sử dụng khả năng bắt chước phân tử như nhau hay không. Do đó, những bệnh nhân mắc COVID-19 nặng dễ bị loại rối loạn biết dưới tên “suy giảm corticosteroid liên quan với bệnh lý nặng cần hồi sức” (CIRCI). Tuy nhiên, dữ liệu về chức năng của cortisol ở bệnh nhân COVID-19 vẫn chưa có. Một thử nghiệm lâm sàng về hiệu quả và độ an toàn của corticosteroid trong COVID-19 hiện đang được tiến hành. Tuy nhiên, bệnh nhân bị suy thượng thận tiên phát tiềm tàng ( PAI) có nguy cơ cao bị nhiễm trùng đường hô hấp dưới và do đó cần phải có các biện pháp phòng ngừa bổ sung giữa đại dịch. Họ nên biết guideline trong ngày ốm và tự tăng liều corticosteroid bất cứ khi nào nghi ngờ có COVID-19 để cơn bão thượng thận. Bệnh nhân PAI mắc COVID-19 có thể thêm glucocorticoid đường tiêm; Kali huyết thanh nên được theo dõi chặt chẽ ở những bệnh nhân này, vì đã có báo cáo về hạ kali máu ở những bệnh nhân bị COVID-19.
- COVID-19 và tuyến dưới đồi- tuyến yên
Trong các triệu chứng thần kinh xảy ra ở bệnh nhân COVID-19 có hyposmia (giảm khứu giác). Sự tiết ACE2 bởi các tế bào biểu mô khứu giác có thể giải thích phần lớn việc giảm khứu giác. Đường xâm nhập của vi rút vào hệ thần kinh trung ương (CNS) vẫn chưa được biết chắc chắn, có thể qua đường máu hoặc trực tiếp qua mảnh sàng xương sàng. Các mô vùng hạ đồi và tuyến yên tiết ACE2 và về mặt lý thuyết có thể là mục tiêu của virus. Trên thực tế, nhờ khám nghiệm tử thi, thấy được hiện tượng phù nề và thoái hóa tế bào thần kinh cùng với việc xác định bộ gen SARS xảy ra ở vùng dưới đồi. Bằng chứng sinh hóa về sự liên quan của vùng dưới đồi-tuyến yên trong SARS lần đầu tiên được báo cáo bởi Leow và những cộng sự. vào năm 2005. 61 người sống sót sau SARS được đánh giá sau 3 tháng hồi phục và định kỳ sau đó. 40% bệnh nhân có bằng chứng về suy thượng thận thứ phát (tổn thương trung ương) – Central hypocortisolism, phần lớn (62,5%) khỏi trong vòng một năm. Đáng chú ý, 87,5% những người bị suy thượng thận thứ phát (tổn thương trung ương) từng mệt mỏi và / hoặc chóng mặt tư thế vào đợt khám đầu tiên. Một tỷ lệ nhỏ bệnh nhân (5%) cũng bị suy giáp trung ương (central hypothyroidism). Các tác giả đề xuất rằng viêm tuyến yên có hồi phục hoặc tổn thương trực tiếp vùng dưới đồi có thể gây rối loạn trục tuyến yên-dưới đồi. Hiện tại, chúng tôi không có bất kỳ dữ liệu nào như vậy về bệnh nhân mắc COVID-19; tuy nhiên, xem xét tần suất cao các triệu chứng thần kinh, người ta cho rằng SARS-CoV-2 cũng có thể ảnh hưởng đến vùng dưới đồi – tuyến yên, trực tiếp hoặc qua viêm tuyến yên tự miễn. Theo đó, các bác sĩ nên có một ngưỡng thấp để nghi ngờ chứng suy thượng thận thứ phát (tổn thương trung ương) ở những người sống sót sau COVID-19, đặc biệt là những người thường mệt mỏi không rõ nguyên nhân, buồn bực, khó chịu, chóng mặt tư thế đứng, chán ăn và thờ ơ. Bệnh nhân bị rối loạn tuyến yên-vùng dưới đồi thường bị đái tháo nhạt tiềm tàng (DI); COVID-19 ở bệnh nhân DI có thể dẫn đến mất nước qua tuyến mồ hôi, sự bay hơi từ bề mặt da và hô hấp do sốt và thở gấp, cuối cùng dẫn đến tăng natri máu (hypernatremia). Do đó, bệnh nhân và bác sĩ điều trị cần thận trọng trong vấn đề này.
- COVID-19 và tuyến giáp
Dữ liệu về sự liên quan giữa tuyến giáp và virus corona là hiếm nhất. Một nghiên cứu được thực hiện trong đợt bùng phát dịch SARS năm 2003 đã báo cáo rằng nồng độ T3 và T4 trong huyết thanh thấp hơn ở bệnh nhân SARS so với nhóm đã được kiểm soát trong giai đoạn cấp tính và điều trị. Điều này có thể do hội chứng bệnh lý bình giáp (sick-euthyroid syndrome) tiềm ẩn. Bệnh nhân nặng có hội chứng bệnh lý bình giáp thường có trọng lượng tuyến giáp trung bình thấp hơn do giảm kích thước nang giáp liên quan đến sự cạn kiệt chất keo. Tuy nhiên, một nghiên cứu khám nghiệm tử thi ở 5 bệnh nhân bị SARS đã cho thấy sự phá hủy rõ rệt các tế bào nang và mô nang của tuyến giáp. Sự phá hủy các tế bào nang sẽ biểu hiện dưới tình trạng T3 và T4 thấp; Về mặt lý thuyết, tổn thương tế bào parafollicular (tế bào C) sẽ dẫn đến nồng độ calcitonin huyết thanh thấp. Điều này được cho là một cơ chế hợp lý cho sự hoại tử xương chỏm xương đùi được thấy ở những bệnh nhân SARS đã hồi phục; thiếu calcitonin sẽ không còn sự ức chế hủy xương, dẫn đến hoại tử xương. Chưa có dữ liệu về chức năng tuyến giáp hoặc bệnh lý tuyến giáp trong COVID-19. Hiệp hội Tuyến giáp Anh và Hiệp hội Nội tiết (BTA / SfE) đã đưa ra một tuyên bố đồng thuận liên quan đến các vấn đề cụ thể đối với rối loạn chức năng tuyến giáp trong đại dịch COVID-19. Bệnh nhân bị suy giáp hoặc cường giáp cơ bản nên tiếp tục dùng thuốc theo chỉ định như bình thường. Tuy nhiên, bệnh nhân dùng thuốc kháng giáp (ATDs) có nguy cơ giảm bạch cầu hạt, mặc dù hiếm khi xảy ra. Các triệu chứng giảm bạch cầu hạt thường giống với các triệu chứng của COVID-19, dẫn đến thường khó phân biệt bệnh này với bệnh kia trên lâm sàng. Do đó, bệnh nhân đang điều trị ATD có các triệu chứng gợi ý mất bạch cầu hạt nên ngừng thuốc ngay lập tức và làm công thức máu đầy đủ sớm nhất.
- Kết luận
Trong bối cảnh đại dịch đang diễn ra, sự liên quan giữa hệ nội tiết với COVID-19 phần lớn vẫn chưa được khám phá. Các dữ liệu nói trên liên quan đến COVID-19 và hệ nội tiết chủ yếu là phỏng đoán và dữ liệu thực tế tại thời điểm này. Các kết luận đã được xác thực không được công bố dựa trên dữ liệu hiện tại, vì phần lớn các quan sát được dựa trên kinh nghiệm trước đây về SARS và trên các tài liệu thu được gần đây từ các nghiên cứu quy mô nhỏ. Tuy nhiên, dữ liệu cung cấp nhiều kiến thức cho nghiên cứu trong tương lai. Dù nghe có vẻ sớm, bác sĩ nội tiết cần phải nhận thức được những khả năng này trên lâm sàng, đặc biệt là khi khám những người sống sót sau COVID-19. Tài liệu tham khảo:
Nguồn: Covid 19 and the endocrine system: exploring the unexplored
Người dịch: Diệu Hương
Bài viết được dịch thuật và biên tập bởi ykhoa.org – vui lòng không reup khi chưa được cho phép!
 Y khoa Ykhoa, y học, y tế, kiến thức, lâm sàng, cận lâm sàng, chẩn đoán, điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.
Y khoa Ykhoa, y học, y tế, kiến thức, lâm sàng, cận lâm sàng, chẩn đoán, điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.