I- MỤC TIÊU.
■ Định nghĩa những thuật ngữ nguyên tố, nguyên tử, proton, nơ tron và electron
■ Mô tả sự hình thành và ý nghĩa của liên kết ion, liên kết cộng hóa trị, liên kết disulfide và liên kết hidro
■ Mô tả quá trình phản ứng tổng hợp và phản ứng phân hủy
■ Giải thích vai trò của nước trong chức năng sống của cơ thể người.
■ Nêu và mô tả khoang nước
■ Giải thích vai trò của oxy và cacbondioxit trong tế bào hô hấp
■ Các yếu tố vi lượng với tên, và chức năng của chúng
■ Giải thích thang pH. Trạng thái bình thường pH của dịch cơ thể
■ Giải thích vai trò hệ thống đệm với pH
■ Mô tả chức năng của monosaccarid, disaccarid, oligosaccarid và polisaccarid
■ Mô tả chức năng của chất béo, phospholipid và steroid
■ Mô tả chức năng của protein, và giải thích cơ chế hoạt động của các enzyme xúc tác
■ Mô tả chức năng của AND, ARN và ATP
II- NỘI DUNG.
- THUẬT NGỮ MỚI.
– Acid (ASS-sid)
– Amino acid (ah-MEE-noh ASS-sid)
– Atom (A-tum)
– Base (BAYSE)
– Buffer system (BUFF-er SIS-tem)
– Carbohydrates (KAR-boh-HIGHdrayts)
– Catalyst (KAT-ah-list)
– Cell respiration (SELL RES-pi-RAYshun)
– Covalent bond (ko-VAY-lent)
– Dissociation/ionization (dih-SOHsee-AY-shun/EYE-uh-nih-ZAYshun)
– Element (EL-uh-ment)
– Enzyme (EN-zime)
– Extracellular fluid (EKS-trah-SELLyoo-ler)
– Intracellular fluid (IN-trah-SELLyoo-ler)
– Ion (EYE-on)
– Ionic bond (eye-ON-ik)
– Lipids (LIP-ids)
– Matter (MAT-ter)
– Molecule (MAHL-e-kuhl)
– Nucleic acids (new-KLEE-ik ASS-sids)
– pH and pH scale (pee-H SKALE)
– Protein (PROH-teen)
– Salt (SAWLT)
– Solvent/solution (SAHL-vent/ suh-LOO-shun)
– Steroid (STEER-oyd)
– Theory (THEER-ree)
– Trace elements (TRAYSE EL-uhments)
– Acidosis (ASS-i-DOH-sis)
– Atherosclerosis (ATH-er-oh-skleROH-sis)
– Hypoxia (high-POK-see-ah)
– Saturated (SAT-uhr-ay-ted)
– Unsaturated (un-SAT-uhr-ay-ted)
- NỘI DUNG.
Khi bạn nghe hay thấy từ hóa học, bạn có thể nghĩ đến những ống nghiệm và những chiếc cốc trong phòng thí nghiệm hóa học. tuy nhiên, trong cuộc nghiên cứu của chúng tôi về cơ thể người, chúng ta hãy nghĩ rằng phòng thí nghiệm giống như cái nhà bếp với những cái nồi và những cái chảo và đồ ăn ngon đang sôi trên bếp hoặc đang nướng trong lò. Mùi thơm từ thức ăn lan tỏa vào không khí, chúng là hỗn hợp với các chất hóa học dạng khí mà chúng ta vẫn hít vào và thở ra. Những cái nồi và chảo, cũng như giấy của một cuốn sách dạy nấu ăn (làm từ gỗ), là những chất hóa học dạng rắn. nước là dạng chất hóa học dạng lỏng,và tất cả thức ăn của chúng ta đều là những chất hóa học. nhớ lại chương 1 mức tổ chức đơn giản nhất là mức hóa học. cơ thể chúng ta là sự sắp xếp phức tạp của hàng ngàn chất hóa học. vậy từ đâu mà chúng ta có những chất hóa học mới để tạo ra một bộ phận mới hoặc cung cấp năng lượng cho cơ thể? Đúng vậy: từ thức ăn. Nấu ăn ngon là sự nghiên cứu khoa học và cũng là một môn nghệ thuật. và ăn? Tất cả là chất hóa học.
Chương này trình bày một số khía cạnh cơ bản của hóa học vì chúng liên quan đến sinh vật sống và nhất là khi chúng có liên quan đến sự hiểu biết của chúng ta về cơ thể con người. Vì vậy, hãy thử nghĩ về hóa học không là khoa học phức tạp, mà là không khí, là nước, là thức ăn chúng ta cần và chúng là một phần của chúng ta. tuy nhiên, trước khi đi vào các nhóm thức ăn, chúng ta phải bắt đầu với các nguyên tắc cấu trúc hóa học: các nguyên tử của các nguyên tố và các liên kết giữa chúng.
NGUYÊN TỐ
Tất cả vật chất, cả đang sống và không sống, đều được tạo nên từ nguyên tố, những chất hóa học đơn giản nhất. Mỗi nguyên tố được cấu tạo chỉ từ một loại nguyên tử (do đó, mỗi nguyên tử là cấu tạo nhỏ nhất của một nguyên tố). hiện tại đã tìm ra 92 loại nguyên tố tự nhiên xung quanh chúng ta trên thế giới.ví dụ như hidro (H), sắt (Fe), oxi (O), canxi (Ca), nito (N), và cacbon (C). trong tự nhiên, một nguyên tố không tồn tại ở dạng nguyên chất mà thường kết hợp với các nguyên tử của các nguyên tố khác tạo thành hợp chất. vì dụ một số hợp chất quan trọng trong nghiên cứu cơ thể người là nước (H2O), trong đó có hai nguyên tử hidro liên kết với một nguyên tử oxi: cacbondioxit (CO2), trong đó có một nguyên tử cacbon liên kết với hai nguyên tử oxi: glucose (C6H12O6), trong đó sáu nguyên tử cacbon và sáu nguyên tử oxi liên kết với mười hai nguyên tử hidro.
Những nguyên tố cacbon, hidro, oxi, nito, phốt-pho, và lưu huỳnh được tìm thấy trong mọi vật sống. Nếu tính cả canxi, thì bảy yếu tố này sẽ tạo thành khoảng 99% cơ thể người ( về trọng lượng).
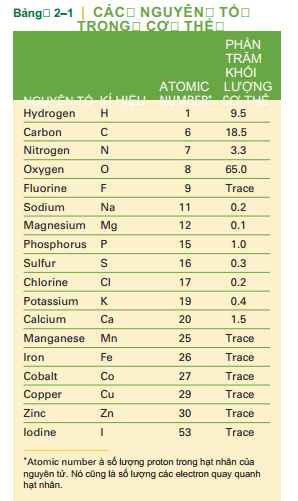
Hơn 20 nguyên tố hóa học khác nhau đã được tìm thấy, số lượng đang thay đổi, trong cơ thể người. một số đã được liệt kê ở bảng 2-1. Như bạn thấy, mỗi nguyên tố có một ký hiệu hóa học chuẩn. Đó là chữ cái thứ nhất (và có khi là thứ hai) trong tên Tiếng Anh hoặc tiếng Latin của nguyên tố đó. Bạn nên biết về kí hiệu của các nguyên tố có trong bảng này, bởi vì chúng được sử dụng trong sách giáo khoa, các bài viết, các xét nghiệm, v.v. lưu ý rằng nếu một nguyên tố được ký hiệu bởi hai chữ cái thì chữ cái thứ hai luôn được viết thường, không phải viết hoa. Ví dụ, ký hiệu của canxi là Ca, không phải CA. CA là chữ viết tắt thường dùng thay cho từ ung thư.
NGUYÊN TỬ
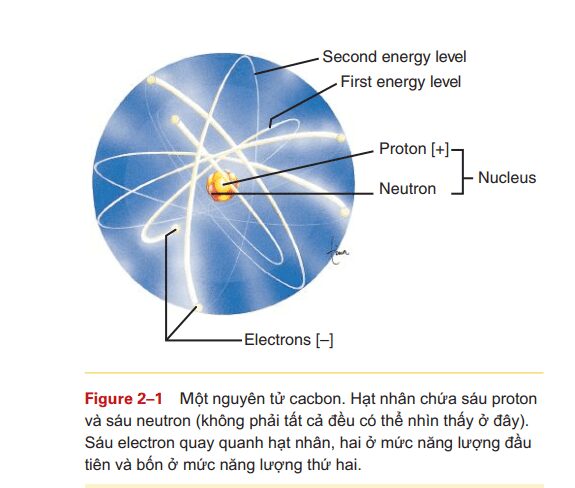
Nguyên tử là cấu tạo nhỏ nhất của một nguyên tố và mang những tính chất của nguyên tố đó. Mỗi nguyên bao gồm ba tiểu đơn vị hoặc hạt chính: proton, notron và electron. Proton là hạt mang điện tích dương được tìm thấy trong hạt nhân ( trung tâm) của nguyên tử. Electron là một hạt mang điện tích âm và được tìm thấy ở vùng ngoài xoay quanh hạt nhân được gọi là đám mây electon hay lớp vỏ ngoài hạt nhân.
Số lượng proton trong một nguyên tử chính là số hiệu nguyên tử đó. Proton và electron đều có khối lượng và trọng lượng: chúng tạo thành trọng lượng của nguyên tử. trong một nguyên tử, số lượng hạt proton (+) bằng số electron (-): do đó, một nguyên tử luôn trung hòa về điện. electron, bằng cách nào đó, là rất quan trọng đó là chúng có thể hoạt hóa một nguyên tử hay tạo liên kết với các nguyên tử khác tạo thành phân tử. một phân tử là sự kết hợp của nhiều nguyên tử ( thường là nhiều hơn một phần tử) chúng liên kết chặt chẽ với nhau và phân tử hoạt động như một đơn vị duy nhất.
Mỗi nguyên tử có khả năng liên kết rất đặc trưng. Khả năng này phụ thuộc vào số lượng và trình tự sắp xếp của các electron. electron di chuyển theo quỹ đạo của hạt nhân trong lớp vỏ hay các mức năng lượng. lớp đầu tiên, hay lớp trong cùng, mức năng lượng có thể gồm tối đa hai electron và giữ mức ổn định. Mức năng lượng thứ hai cũng là mức ổn định khi nó gồm tối đa tám electron các mức năng lượng còn lại, khoảng cách đến hạt nhân xa hơn, cũng vững bền khi có tám electron hoặc bội số của tám.
Một số ít nguyên tử ( phần tử) vững bền ở dạng tự nhiên, hoặc không tạo phản ứng, bởi vì mức năng lượng của lớp ngoài cùng đã chứa tối da lượng electron có thể có. Khí heli và neon là những ví dụ cho sự vững bền này, chúng gần như không có phản ứng với các nguyên tử khác. Hầu hết các nguyên tử đều không bền vững, tuy nhiên, và có xu hướng nhận them, cho đi, hay trao đổi electron với các nguyên tử khác để làm đầy vào lớp vỏ ngoài cùng của chúng. Bằng cách đó, một nguyên tử có khả năng tạo một hoặc nhiều liên kết hóa học với các nguyên từ khác. Do đó, các nguyên tử trở nên bền vững vì lớp vỏ electron ngoài cùng đã đầy hết. những phản ứng hóa học này hữu ích nhất trong quá trình nghiên cứu giải phẫu và sinh lý cơ thể người.
LIÊN KẾT HÓA HỌC
Liên kết hóa học không phải là một cấu trúc, mà là một lực, hay là sự tác động giữa điện tích âm và điện tích dương. Liên kết hóa học giữ cho liên kết giữa hai hay nhiều các nguyên tử liên kết chặt chẽ với nhau trong cùng một phân tử. bằng cách so sánh với lực hấp dẫn. chúng ta biết rằng, trọng lực không phải là một vật, mà là lực giữ bàn chân chúng ta ở trên mặt đất và cho phép chúng ta rót được những giọt cà phê. Các phân tử được tạo thành từ các liên kết hóa học thường mang tình chất vật lí khác với các nguyên tử của nguyên tố ban đầu. ví dụ, các nguyên tố hidro và oxi là những chất khí, chúng có thể liên kết hóa học với nhau tạo thành nước, là một chất lỏng.
Kiểu liên kết hóa học phụ thuộc vào hướng trao đổi electron của các thành phần nguyên tử, như bạn sẽ thấy.Có bốn kiểu liên kết hóa học quan trọng trong cơ thể người: liên kết ion, liên kết cộng hóa trị, liên kết disulfide và liên kết hidro.
LIÊN KẾT ION
Một liên kết ion bao gốm sự mất đi của một hay nhiều electron của một nguyên tử và sự nhận thêm electron bởi một hay nhiều nguyên tử khác. Xem thêm hình 2-2 dưới đây.
Mỗi nguyên tử natri (Na) có một electron ở lớp vỏ ngoài cùng,và, để trở nên bền vững nó có xu hướng cho đi electron. khi đó, nguyên tử natri sẽ có số lượng proton nhiều hơn một so với electron. do đó, lúc này nó mang điện tích (hóa trị) là +1 và được gọi là ion natri. Một nguyên tử clo có bảy electron ở lớp vỏ ngoài cùng, và để bền vững hơn nó có xu hướng nhận thêm một electron. khi đó, nguyên tử clo sẽ có số lượng electron nhiều hơn số proton và mang điện tích (hóa trị) -1. Đó gọi là ion clo.\
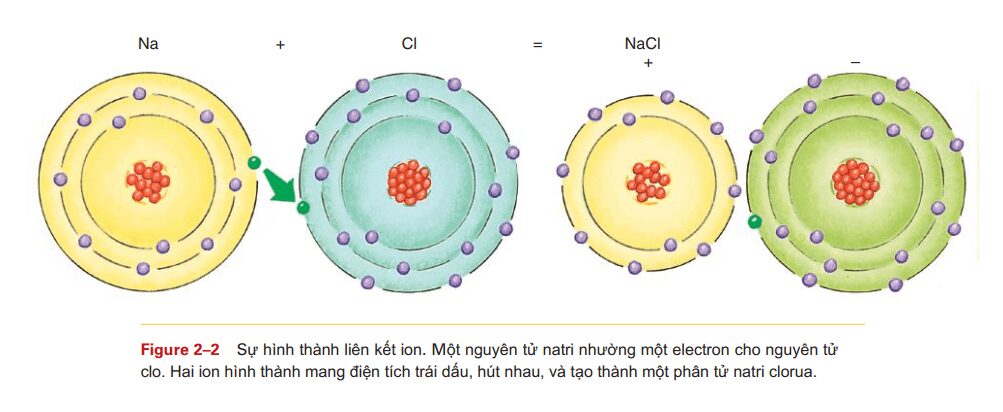
Khi một nguyên tử natri cho nguyên tử clo một electron, ion của chúng mang điện tích trái dấu (âm và dương), và chúng hút nhau. Kết quả là tạo thành một phân tử natriclorit: NaCl hay là muối ăn thông thường. liên kết giữ các ion luôn hút nhau được gọi là liên kết ion.
Một ví dụ khác là liên kết giữa clo và canxi. Mỗi nguyên tử canxi có hai electron ở lớp vỏ ngoài cùng và có xu hướng cho đi hai electron đó để trở nên bền vững ( ion canxi, Ca+2). Nếu có hai nguyên tử clo mỗi nguyên tử clo nhận một electron, chúng trở thành ion clo. Những ion âm và ion dương sau đó hút nhau tạo thành phân tử canxiclorua, CaCl2, cũng là muối. Muối là phân tử được tạo thành từ những ion khác ion hidro (H+) hay ion hydroxit (OH-).
Những ion mang điện tích dương được gọi là cations. Gồm có ion Na+, Ca+2, K+, Fe+2, và Mg+2. Những ion mang điện tích âm được gọi là anions, gồm có Cl-, SO4-2(sulfat), and HCO3- (bicarbonat). Các hợp chất được tạo thành từ liên kết ion được gọi là muối, axit, và bazo.(axit và bazo sẽ được trình bày ở những chương sau).
Ở thể rắn, các liên kết ion khá là bền vững. Xương của chúng ta, là một ví dụ, gồm các muối canxi cacbonat, giúp cho xương luôn rắn chắc. trong một dung dịch nước (nước), có nhiều liên kết ion yếu. các liên kết trở nên yếu hơn liên kết ion của các phân tử riêng biệt, chúng tách ra tạo thành dung dịch chứa những ion dương và ion âm tự do. Ví dụ, nếu cho dung dịch clorua vào nước, chúng sẽ hòa tan và sau đó ion hóa. Sự ion hóa, hay là sự phân ly, có vai trò quan trọng đối với cơ thể sống vì những ion tự do sẽ tham gia vào các phản ứng hóa học trong cơ thể. Tế bào thành dạ dày phải có ion Cl- để sản xuất axit clohidric (HCl). Clo trong muối NaCl sẽ không thể tách ra thành dạng tự do để tham gia vào phản ứng này vì liên kết của nó với natri vững bền hơn. Tuy nhiên, Cl- luôn có sẵn bị ion hóa NaCl nhờ nước trong tế bào có thể sử dụng cho sự tổng hợp, hay sản xuất chất hóa học, của HCl trong dạ dày.
LIÊN KẾT CỘNG HÓA TRỊ
Liên kết cộng hóa trị bao gồm sự dung chung các electron giữa các nguyên tử. như hình 2-3, một nguyên tử oxi cần thêm hai electron để đạt trạng thái bền vững. bằng cách đưa hai electron của nó ra dung chung với một nguyên tử oxi khác cũng cần hai electron. chúng cùng tạo thành một phân tử khí oxi (O2), là dạng tồn tại trong khí quyển.
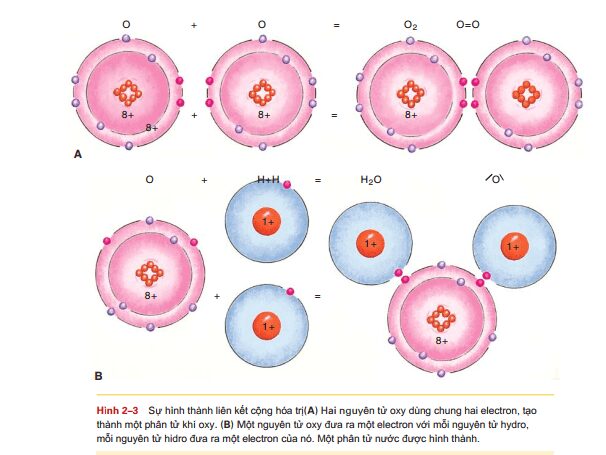
Một nguyên tử oxi có thể dung chung hai electron với hai nguyên tử hidro, mỗi nguyên tử hidro dung một electron ( hình 2-3). Chúng cùng tạo thành một phân tử nước (H2O). khi viết công thức cấu tạo của một phân tử, một cặp electron dùng chung được thể hiện bằng dấu gạch ngang, như hình 2-3, cấu tạo của nước: đó là một liên kết đơn. Một liên kết đôi được thể hiện bởi hai dấu gạch ngang, như cấu tạo của phân tử oxi, là kết quả của sự dùng chung hai cặp electron.
Nguyên tố cacbon luôn tạo thành liên kết cộng hóa trị: một nguyên tử cacbon có bốn electron để dùng chung với các nguyên tử khác. Nếu cả bốn electron này đều dùng mỗi nguyên tử một eletron, thì sẽ tạo thành phân tử khí metan (CH4). Cacbon có thể tạo liên kết cộng hóa trị với các nguyên tử cacbon khác, hidro, oxi, nito và các nguyên tố khác nữa. các hợp chất hữu cơ như protein và cacbonhydrat là phức hợp và sắp xếp nghiêm ngặt của các nguyên tử này, liên kết cộng hóa trị với nhau. Liên kết cộng hóa trị là liên kết tương đối bền vững và không bị suy yếu trong môi trường nước. điều này rất quan trọng vì protein được tạo ra bởi cơ thể người, trong cơ và da, ví dụ, phải duy trì chức năng toàn vẹn trong nước của tế bào và máu. Chức năng của các hợp chất hữu cơ sẽ được trình bày ở chương sau.
LIÊN KẾT DISULFUA VÀ LIÊN KẾT HIDRO
Hai loại liên kết hóa học khác cũng rất quan trọng trong hóa học cơ thể người nữa là liên kết disulfua và liên kết hidro. Liên kết disulfua được tìm thấy trong một số protein. Liên kết hidro là một phần của nhiều phân tử khác.
Liên kết disulfua ( hay còn gọi là cầu nối disulfua) là liên kết hóa học được tạo thành bởi hai nguyên tử lưu huỳnh, thường trong cùng một phân tử protein lớn. hoocmon insulin, là một ví dụ, là một protein phải có không gian ba chiều để hoạt động chức năng điều chỉnh lượng đường trong máu. Mỗi phân tử insulin có hai liên kết disulfua giúp duy trì hình dạng và chức năng của nó ( xem bảng 10-A ở chương 10). Một protein khác có hình dạnh phụ thuộc vào liên kết disulfua là kháng thể của hệ miễn dịch ( hình 14-8 chương 14) và keratin của da và tóc.
Một sợi tóc duy trì hình dạng của nó ( một đặc tính di truyền) nhờ vào liên kết disulfua. Khi kéo thẳng tóc xoăn tự nhiên, liên kết disulfua trong phân tử keratin bị cắt đứt. khi uốn hoặc làm xoăn tóc thẳng tự nhiên, liên kết disulfua trong phân tử keratin đầu tiên bị cắt đứt, sau đó tái tạo lại tạo thành sợi tóc xoăn. Điều này cũng không ảnh hưởng đến sự sống của một bộ phận của tóc, gốc tóc, do đó tóc sẽ dài ra theo hình dạng ban đầu của nó. Chúng ta không muốn quá trình đó ảnh hưởng đến insulin hay các kháng thể, vì điều đó phá hủy chức năng của chúng.
Một liên kết hidro không phải là sự dùng chung hay trao đổi electron, mà là kết quả của sự sở hữu các nguyên tử hidro. Khi một nguyên tử hidro đưa ra một electron để tạo liên kết cộng hóa trị với nguyên tử khác, thì proton của nó hơi tích điện dương và sau đó có thể hút các nguyên tử oxi hay nito ở gần đo, những nguyên tử hơi tích điện âm.
Dù là liên kết yếu, liên kết hidro vẫn có vai trò quan trọng đặc biệt. các phân tử hữu cơ lớn như protein và AND có trong nhiễm sắc thể của chúng ta có được những chức năng đặc biệt đó là dựa vào cấu trúc không gian ba chiều của chúng ( hình 2-10). Cấu trúc của những phân tử này, có vai trò quyết định chức năng của chúng, thường được duy trì bằng liên kết hidro. Liên kết hidro cũng làm cho các phân tử nước kết gắn vào nhau. Sự gắn kết là xu hướng của các phân tử giống nhau dính kết vào nhau. trong một cốc nước, ví dụ, mỗi phân tử nước bị thu hút bởi các phân tử nước xung quanh. Một phân tử nước tạo thành bốn liên kết hidro, một trong số đó sẽ tạo liên kết với một trong bốn liên kết hidro của phân tử nước khác. Mỗi một phân tử có thể tạo thành bốn liên kết hidro với các phân tử khác, cứ như thế, làm cho các phân tử nước gắn kết lại với nhau. Nước cũng có thể kết dính với các phân tử khác. Sự kết dính là xu hướng hút nhau của các phân tử không giống nhau. Cả sự gắn kết hay và sự kết dính của các phân tử nước đều là những gì giữ cho sự vững vàng của lâu đài cát. Sự gắn kết của nước có thể được nhìn thấy nếu nước bị rơi vào kính sạch: sức căng bề mặt do liên kết hidro tạo ra làm cho nước hình thành các hạt có cấu trúc không gian ba chiều. trong cơ thể người, sự gắn kết của nước giúp cho dòng máu chảy theo một chiều liên tục trong mạch máu và chất lỏng mô liên tục xung quanh tế bào. Các liên kết hydro này cũng chịu trách nhiệm cho các đặc điểm quan trọng khác của nước, được thảo luận trong phần sau.
Phản ứng hóa học là một sự thay đổi được tạo ra bởi sự hình thành hoặc phá vỡ các liên kết hóa học. Hai loại phản ứng tổng quát là phản ứng tổng hợp và phản ứng phân hủy.
Trong phản ứng tổng hợp, các liên kết được hình thành để ghép hai hoặc nhiều nguyên tử hoặc phân tử để tạo ra một hợp chất mới.
Việc sản xuất protein hemoglobin trong các tiền hồng cầu là một ví dụ về phản ứng tổng hợp. Protein được tổng hợp bởi sự liên kết của nhiều axit amin, tiểu đơn vị nhỏ hơn của chúng. Phản ứng tổng hợp đòi hỏi năng lượng cho sự hình thành các liên kết.
Trong một phản ứng phân hủy, các liên kết bị phá vỡ và một phân tử lớn được giáng hóa thành hai hoặc nhỏ hơn. Một ví dụ là việc tiêu hóa các phân tử tinh bột lớn thành nhiều phân tử glucose nhỏ hơn. Một số phản ứng phân hủy giải phóng năng lượng; điều này được mô tả trong phần sau về hô hấp tế bào..
Trong các tế bào, tổng hợp thường được kết hợp với phân hủy. Khi màng tế bào hoặc các thành phần mô khác bị hỏng, chúng phải được thay thế. Các cấu trúc cũ hoặc hư hỏng có thể được tái chế cho các bộ phận nhỏ hơn hoặc tiểu đơn vị của chúng. Những phần này có thể là các khoáng chất (như sắt) hoặc các phân tử hữu cơ (như axit amin) và có thể được sử dụng trong các phản ứng tổng hợp tiếp theo. Ví dụ, khi hemoglobin cũ phá vỡ, sắt của nó có thể được sử dụng hết lần này đến lần khác để tổng hợp hemoglobin mới cho các tế bào hồng cầu (điều này sẽ được đề cập trong Chương 11).
Trong chương này và tương lai, hãy nhớ rằng thuật ngữ phản ứng đề cập đến việc tạo ra hoặc phá vỡ liên kết hóa học và do đó thay đổi đặc tính vật lý và hóa học của các phân tử liên quan.
Các chất vô cơ
Các hợp chất vô cơ thường là các phân tử đơn giản thường chỉ bao gồm một hoặc hai thành phần khác nhau. Mặc dù chúng đơn giản, tuy nhiên, một số hợp chất vô cơ là rất cần thiết cho cấu trúc bình thường và chức năng của cơ thể.
NƯỚC
Nước chiếm 55% đến 70% cơ thể con người và rất cần thiết cho cuộc sống vì nhiều lý do:
- Nước là một dung môi; có nghĩa là, nhiều chất (gọi là chất tan) có thể hòa tan trong nước. Các chất dinh dưỡng như glucose được hòa tan trong huyết tương (phần lớn là nước) để được vận chuyển đến các tế bào khắp cơ thể. Sự bài tiết của các sản phẩm chất thải là có thể bởi vì các sản phẩm được hòa tan trong nước tiểu được sản xuất bởi thận. Các giác quan cho phép chúng ta thưởng thức thức ăn, hương vị và mùi, cả hai đều phụ thuộc vào khả năng dung môi của nước. Các phân tử thực phẩm hòa tan trong nước bọt kích thích các thụ thể trong vị giác trên lưỡi. Phân tử thực phẩm bốc hơi (đặc biệt là từ thức ăn nóng) được ngửi vào khoang mũi trên, nơi chúng hòa tan trong màng nước mỏng và kích thích các thụ thể khứu giác. Thực phẩm nóng thường có vẻ ngon hơn thức ăn lạnh vì cảm giác về mùi góp phần nhiều hơn vào nhận thức của chúng ta về chúng.
- Nước là chất bôi trơn, giúp ngăn ngừa ma sát nơi các bề mặt gặp và di chuyển. Trong đường tiêu hóa, nuốt phụ thuộc vào sự hiện diện của nước bọt, và chất nhầy là một chất lỏng trơn trượt cho phép thực phẩm trôi qua ruột. Dịch khớp trong khoang khớp ngăn ngừa ma sát khi xương di chuyển.
- Nước thay đổi nhiệt độ từ từ. Nước có công suất nhiệt cao, có nghĩa là nó sẽ hấp thụ rất nhiều nhiệt trước khi nhiệt độ tăng lên đáng kể, hoặc nó phải mất rất nhiều nhiệt trước khi nhiệt độ giảm đáng kể. Đây là một trong những yếu tố giúp cơ thể duy trì nhiệt độ không đổi. Nước cũng có nhiệt độ bốc hơi cao, nhiệt cần thiết để thay nước từ chất lỏng thành khí. Điều này rất quan trọng cho quá trình đổ mồ hôi. Nhiệt độ cơ thể dư thừa bốc hơi mồ hôi trên bề mặt da, thay vì làm nóng các tế bào của cơ thể, và do nhiệt độ bốc hơi cao của nước, rất nhiều nhiệt có thể được thải ra với sự mất mát của một lượng nước tương đối nhỏ.
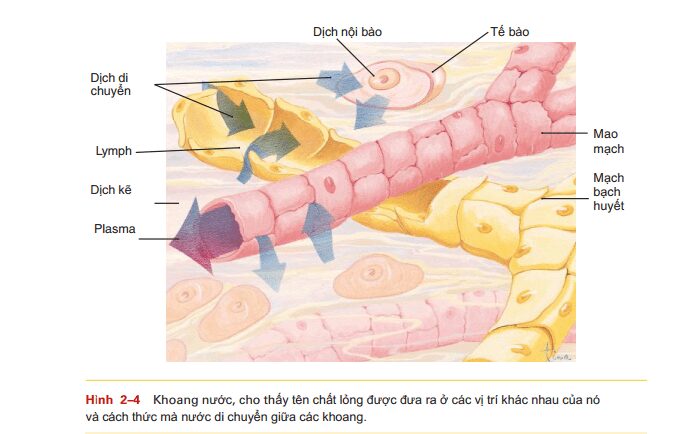
CÁC KHOANG NƯỚC
Tất cả nước trong cơ thể liên tục di chuyển, nhưng nước được đặt tên khác nhau khi nó ở những vị trí cụ thể của cơ thể, được gọi là các khoang (Hình 24): Nội bào (ICF) – nước trong tế bào; chiếm khoảng 65% tổng lượng nước cơ thể Dịch ngoại bào (ECF) – tất cả phần còn lại của nước trong cơ thể; khoảng 35% tổng số. Các khoang cụ thể hơn của dịch ngoại bào bao gồm: Plasma – nước được tìm thấy trong mạch máu Lymph nước được tìm thấy trong mạch bạch huyết Tissue fluid or interstitial fluidnước được tìm thấy trong không gian nhỏ giữa các tế bào Specialized fluidsdịch ở hạch thần kinh, dịch não tủy, dịch nhãn cầu và những nơi khác. Sự chuyển động của nước giữa các khoang trong cơ thể và chức năng của các chất lỏng đặc biệt sẽ được thảo luận trong các chương sau.
OXYGEN
Oxygen ở dạng khí (O2) chiếm khoảng 21% khí quyển mà chúng ta hít vào. Tất cả chúng ta đều biết rằng không có oxy, chúng ta sẽ không tồn tại lâu, nhưng chính xác thì oxy được dùng như thế nào? Ôxy quan trọng đối với chúng ta bởi vì nó là điều cần thiết cho một quá trình gọi là hô hấp tế bào, trong đó các tế bào phân hủy các chất dinh dưỡng đơn giản như glucose để giải phóng năng lượng. Lý do chúng ta hít thở là thu được oxy để hô hấp tế bào và thở ra khí carbon dioxide được sản xuất trong quá trình hô hấp tế bào (điều này sẽ được thảo luận trong phần tiếp theo). Năng lượng hữu ích sinh học được giải phóng bởi các phản ứng hô hấp tế bào được tích lũy trong một phân tử gọi là ATP (adenosine triphosphate). ATP sau đó có thể được sử dụng cho các quá trình di động đòi hỏi năng lượng.
CARBON DIOXIDE
Carbon dioxide (CO2) được sản xuất bởi các tế bào như một sản phẩm thải của hô hấp tế bào. Bạn có thể hỏi tại sao một sản phẩm chất thải được coi là quan trọng. Hãy nhớ rằng Quan trọng không phải lúc nào cũng có nghĩa là có lợi; thay vào đó, nó có thể có nghĩa là đáng kể. Nếu lượng carbon dioxide trong chất lỏng trong cơ thể tăng lên, nó làm cho các chất lỏng này trở nên quá toan. Vì vậy, carbon dioxide phải được thở ra nhanh như nó được hình thành để giữ cho số lượng trong cơ thể trong giới hạn bình thường. Thông thường đây chỉ là những gì xảy ra, nhưng các bệnh phổi nghiêm trọng như viêm phổi hoặc khí thũng làm giảm trao đổi khí trong phổi, dẫn đến sự tích lũy carbon dioxide trong máu. Khi điều này xảy ra, một người được cho là đang trong trạng thái nhiễm toan, có thể làm gián đoạn nghiêm trọng chức năng của cơ thể (xem các phần về pH và các enzym sau này trong chương này; xem thêm bảng 21: Khí máu).
HÔ HẤP TẾ BÀO
Sự hô hấp tế bào là tên cho sản xuất năng lượng trong các tế bào và liên quan đến cả khí hô hấp, oxy và carbon dioxide. Nhiều phản ứng hóa học có liên quan, một số trong đó diễn ra trong các bào quan tế bào gọi là ti thể. Ở dạng đơn giản nhất, hô hấp tế bào có thể được tóm tắt theo phương trình sau: Glucose (C6H12O6) + 6O2→6CO2+ 6H2O + ATP + nhiệt
Phản ứng này cho chúng ta thấy rằng glucose và oxy kết hợp để tạo ra carbon dioxide, nước, ATP và nhiệt. Thực phẩm, đại diện ở đây bởi glucose, trong sự hiện diện của oxy được chia thành các phân tử đơn giản carbon dioxide và nước. Năng lượng tiềm năng trong phân tử glucose được giải phóng dưới hai dạng: ATP và nhiệt. Mỗi một trong bốn sản phẩm của quá trình này có mục đích hoặc tầm quan trọng trong cơ thể. Carbon dioxide là một sản phẩm chất thải di chuyển từ các tế bào vào máu, mang nó đến phổi, nơi nó cuối cùng thở ra. Nước được hình thành rất hữu ích và trở thành một phần của dịch nội bào. Nhiệt được tạo ra góp phần vào nhiệt độ cơ thể bình thường. ATP được sử dụng cho các quá trình tế bào như phân bào, tổng hợp protein và co cơ, tất cả đều cần năng lượng và sẽ được thảo luận thêm một chút về trong văn bản. Chúng ta cũng sẽ trở lại hô hấp tế bào trong các chương sau và với ty lạp thể ở Chương 3. Hiện tại, mô tả ngắn gọn vừa đủ cho thấy ăn và thở có liên hệ với nhau; cả hai đều cần thiết cho sản xuất năng lượng.
CÁC NGUYÊN TỐ VI LƯỢNG
Nguyên tố vi lượng là những yếu tố cần thiết cho cơ thể với số lượng rất nhỏ. Khi chúng có trong thức ăn hoặc bổ sung dinh dưỡng, chúng ta thường gọi chúng là khoáng chất. Ví dụ như sắt (được tìm thấy trong thịt và đậu), coban (chỉ tìm thấy trong thức ăn động vật như gan và cá), magie (được tìm thấy trong rau xanh vì nó là một phần của chất diệp lục) và iốt (có trong muối hải sản và muối iốt). Mặc dù các nguyên tố vi lượng có thể không dồi dào trong cơ thể như carbon, hydro và oxy, tuy nhiên chúng vẫn cần thiết. Bảng 2 2 liệt kê một số nguyên tố vi lượng và chức năng của chúng. Canxi và phốt pho (có trong sữa, pho mát, thịt và cá) được bao gồm trong bảng này, mặc dù chúng cần thiết với số lượng lớn hơn một chút so với những người khác. (Xem thêm Bảng 22: Nitric Oxide.)

ACIDS, BASES, VÀ PH
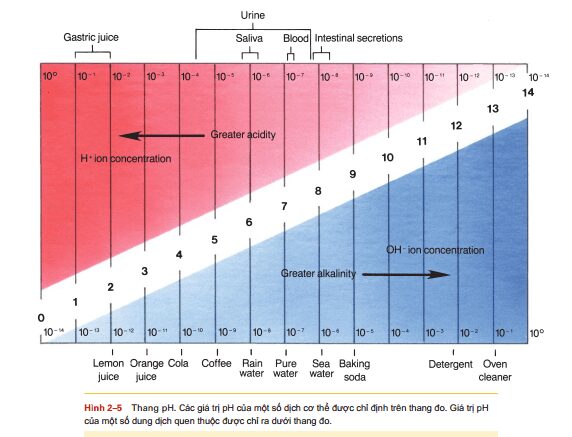
Một axit có thể được định nghĩa là một chất làm tăng nồng độ của các ion hydro (H +) trong một dung dịch nước. Một base là một chất làm giảm nồng độ của ion H +, trong trường hợp của nước, có tác dụng tương tự như tăng nồng độ của các ion hydroxyl (OH).. Độ axit hoặc độ kiềm (độ bazơ) của dung dịch được đo trên thang đo các giá trị gọi là pH (các phần hydro). Các giá trị trên thang đo pH dao động từ 0 đến 14, với 0 cho thấy mức axit cao nhất và 14 là kiềm nhất. Một giải pháp với độ pH 7 là trung tính vì nó chứa cùng số ion H + và ion OH. Nước tinh khiết có độ pH là 7. Dung dịch có nồng độ ion H + cao hơn ion OH – là dung dịch có tính axit với độ pH dưới 7. Do đó, một dung dịch kiềm có nồng độ ion OH cao hơn ion H+ và có độ pH trên 7. Thang đo pH, với nồng độ tương đối của ion H+ và ion OH, được thể hiện trong hình 25. Một sự thay đổi của một đơn vị pH là một sự thay đổi 10 lần nồng độ ion H +. Điều này có nghĩa là dung dịch có độ pH 4 có nhiều ion H + gấp 10 lần như một dung dịch có độ pH lớn gấp 5 và 100 lần so với nhiều ion H + như một dung dịch có độ pH là 6. Hình 25 cũng cho thấy độ pH của một số chất dịch cơ thể và các giải pháp quen thuộc khác. Lưu ý rằng nước dạ dày có độ pH là 1 và cà phê có độ pH là 5. Điều này có nghĩa là nước dạ dày có lượng ion H + gấp 10.000 lần so với cà phê. Mặc dù cà phê có tính axit, nó là một axit yếu và không có tác dụng ăn mòn của dạ dày, một axit mạnh. Các tế bào và chất lỏng bên trong của cơ thể con người có độ pH gần trung tính. Độ pH của dịch nội bào là xung quanh 6,8-7,0, và phạm vi pH bình thường của máu là 7,35 đến 7,45. Các chất lỏng như dịch dạ dày và nước tiểu là các chất lỏng kỹ thuật bên ngoài vì chúng nằm trong các vùng cơ thể mở ra môi trường. Độ pH của các chất lỏng này có thể có tính axit hoặc kiềm mạnh hơn mà không gây hại cho cơ thể. Độ pH của máu, tuy nhiên, phải được duy trì trong phạm vi rất hẹp và hơi kiềm của nó. Chỉ giảm một đơn vị pH, đó là 10 lần so với nhiều ion H +, sẽ phá vỡ các phản ứng hóa học của máu và gây ra cái chết của bản thân. Sự trao đổi chất bình thường có xu hướng làm cho dịch cơ thể có tính axít cao hơn, và xu hướng nhiễm toan này phải được điều chỉnh liên tục. PH bình thường của dịch trong cơ thể được duy trì bởi thận, hệ thống hô hấp và hệ thống đệm. Mặc dù cân bằng acid-base sẽ là chủ đề chính của Chương 19, chúng tôi sẽ đề cập ngắn gọn đến các hệ thống đệm ở đây.
Hệ thống đệm
Một hệ thống đệm là một hóa chất hoặc một cặp hóa chất giảm thiểu những thay đổi về pH bằng cách phản ứng với các axit mạnh hoặc các bazơ mạnh để biến đổi chúng thành những chất không thay đổi đáng kể pH. Nói cách khác, một bộ đệm có thể liên kết với ion H + khi chất lỏng trong cơ thể trở nên quá chua, hoặc giải phóng ion H + khi chất lỏng trở nên quá kiềm. Chúng tôi sẽ sử dụng hệ thống đệm bicarbonate như một ví dụ cụ thể. Hệ thống này bao gồm axit cacbonic (H2CO3), axit yếu và natri bicarbonate (NaHCO3), là một bazơ yếu. Cặp hóa chất này có mặt trong tất cả các chất dịch của cơ thể nhưng đặc biệt quan trọng để đệm máu và dịch mô. Axit cacbonic ion hóa như sau (nhưng hãy nhớ, bởi vì nó là một axit yếu nó không đóng góp nhiều ion H+ vào một giải pháp): H2CO3→ H++ HCO3– Natri bicacbonat phân li như sau: NaHCO3→ Na++ HCO3– Nếu một axit mạnh, chẳng hạn như HCl, được thêm vào dịch ngoại bào, phản ứng sau sẽ xảy ra: HCl + NaHCO3→ NaCl + H2CO3 Điều gì đã xảy ra ở đây? Axit clohiđric, một loại axit mạnh có thể làm giảm pH, đã phản ứng với natri bicarbonate. Các sản phẩm của phản ứng này là NaCl, một muối không ảnh hưởng đến pH, và H2CO3, một axit yếu làm giảm pH chỉ một chút. Điều này ngăn cản sự thay đổi mạnh mẽ về độ pH của dịch ngoại bào.Nếu một bazơ mạnh, chẳng hạn như natri hydroxit, được thêm vào dịch ngoại bào, phản ứng này sẽ xảy ra: NaOH + H2CO3→ H2O + NaHCO3 Natri hydroxide, một chất kiềm mạnh có thể làm tăng pH, đã phản ứng với axit cacbonic. Các sản phẩm của phản ứng này là nước, không ảnh hưởng đến pH và natri bicarbonate, một chất yếu làm tăng pH chỉ một chút. Một lần nữa, điều này ngăn cản một sự thay đổi mạnh mẽ trong độ pH của dịch ngoại bào.
Trong cơ thể, các phản ứng như vậy diễn ra trong chưa đầy một giây bất cứ khi nào axit hoặc bazơ được hình thành sẽ làm thay đổi pH rất nhiều. Do xu hướng của cơ thể trở nên có tính axit hơn, nên nhu cầu giảm toan thường xuyên hơn. Đối với hệ thống đệm bicarbonate, điều này có nghĩa là cần nhiều NaHCO3 hơn H2CO3. Vì lý do này, tỷ lệ thông thường của các bộ đệm này là 20:1 (NaHCO3:H2CO3).
CÁC HỢP CHẤT HỮU CƠ QUAN TRỌNG
Các hợp chất hữu cơ đều chứa các liên kết cộng hóa trị của nguyên tử cacbon, hidro và có thể có thêm các nguyên tử nguyên tố khác nữa. Trong cơ thể người có 4 hợp chất hữu cơ chính, đó là: carbohydrates, lipids, proteins, and acids nucleic.
CARBOHYDRATES
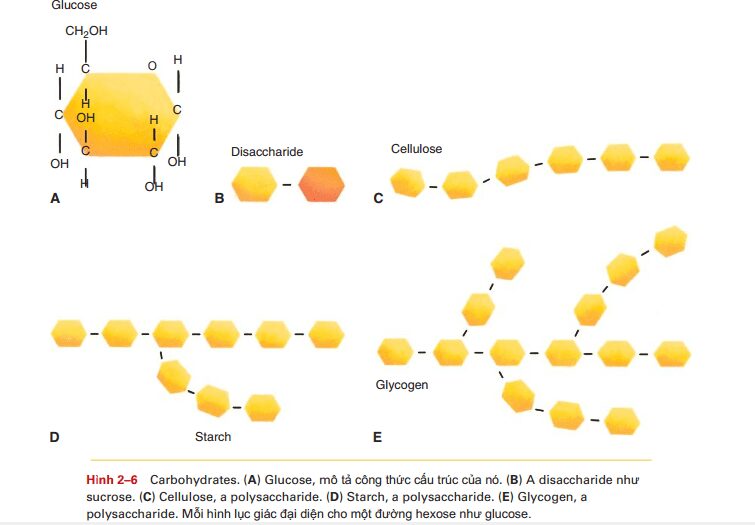
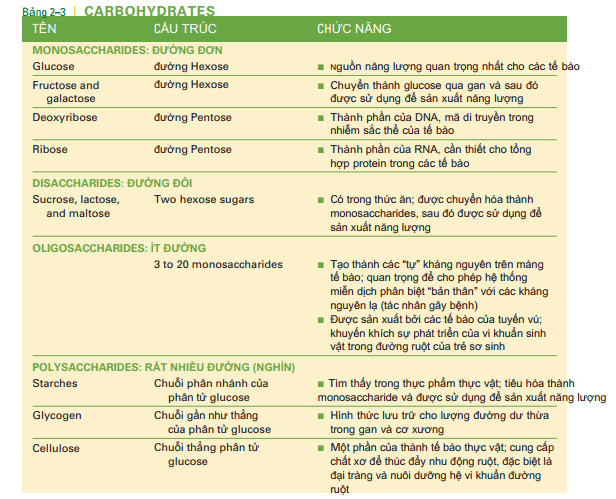
Chức năng cơ bản của cacbonhydrat là cung cấp nguồn năng lượng cho quá trình hô hấp tế bào. Tất cả các cacbonhydrat đều chứa cacbon, hydro và oxy và được phân loại thành monosaccarit, disaccarit, oligosaccarit và polisaccarit. saccarit có nghĩa là đường và các tiền tố cho biết có bao nhiêu phân tử đường. Monosaccharides, hay còn gọi là phân tử đường đơn, là loại đơn giản nhất. Glucose là một đường đơn với 6 nguyên tử cacbon (Hình 2-6). Frutose và galactose có cùng một công thức, nhưng sự sắp xếp vật lý các nguyên tử cacbon, hydro và oxy trong mỗi loại đường là khác nhau. Điều này đưa đến mỗi dạng đường có hình dạng không gian khác nhau. Mật được sản xuất bởi ong bao gồm fructose và glucose. Nước hoa quả gồm fructose(glucose không có vị ngọt). Galactose thường là 1 phần của đường đôi lactose trong sữa. Gan có thể biến đổi frutose và galactose thành glucose, sau đó được sử dụng cho các tế bào trong quá trình hô hấp tế bào để tạo năng lượng ATP. Một loại đường đơn khác là đường pentose hay là đường 5C. Nó không tham gia vào quá trình sản xuất năng lượng nhưng là thành phần cấu trúc acids nucleic. Đường deoxyribose C5H10O4 là 1 phần của DNA, là vật liệu di truyền của nhiễm sắc thể. Đường Ribose C5H10O5 là 1 phần của RNA, là yếu tố cần thiết cho sự tổng hợp protein. Chúng ta sẽ nhắc lại về acids nucleic ở phần sau của chương này. Disaccharides Disaccharides là đường đôi, được tạo bởi 2 monosaccharides liên kết với nhau bởi liên kết cộng hóa trị. Khi liên kết này được hình thành, 1 phân tử nước bị loại bỏ, nên công thức của đường đôi không gấp đôi 1 phân tử đường, mà nó là C12H22O11. Sucrose hay đường mía, ví dụ, được làm bởi 1 glucose và 1 fructose, nó có thể được tìm thấy trong mía và các rau củ quả khác.
 Lactose được cấu tạo từ 1 glucose và 1 galactose, nó được tìm thấy trong sữa,kem,sữa chua và các sản phẩm sữa khác. Đường ngủ cốc maltose được tạo bởi 2 phân tử glucose. Đường đôi trong thức ăn của chúng ta được tiêu hóa thành các đường đơn để sau đó sử dụng cho sản xuất năng lượng. Tiền tố oligo có nghĩa làmột ít; oligosaccharides gồm 3 đến 20 monosaccharide. Không như các cacbodydrates khác, các oligo không là nguồn năng lượng cho chúng ta vì ta không thể tiêu hóa chúng. Trong tế bào người, các oligo được tìm thấy trên bề mặt ngoài màng tế bào. ở đây chúng đáp ứng như là các kháng nguyên là các yếu tố hóa học hoặc là dấu hiệu chỉ điểm (signposts) để nhận diện tế bào. Nhóm máu A.B và AB,ví dụ, là kết quả của các kháng nguyên oligosaccharide trên bề mặt ngoài màng tế bào máu. Tất cả các tế bào của chúng ta đều có các tự kháng nguyên, đê nhận diện các tế bào thuộc từng cá thể.Sự có mặt của các tự kháng nguyên trên các tế bào chủ của chúng ta cung cấp 1 sự so sánh cho các tế bào bạch cầu của hệ thống miễn dịch để sử dụng với các vật liệu lạ, các tế bào bạch cầu có thể tiếp tục nhận ra các kháng nguyên không phải là các tự kháng nguyên. Những kháng nguyên khác bao gồm vi khuẩn,vi rút, và miễn dịch sẽ là chủ đề chính trong chương 14. Các oligosaccarit khác nhau được sản xuất bởi các tế bào tuyến vú và trở thành một phần của sữa mẹ. những cacbonhydrat không phải là nguồn nuôi dưỡng của trẻ sơ sinh đang bú sữa mẹ ( sữa chứa lactose cho em bé) mà là khuyến khích sự sinh trưởng của hệ vi khuẩn có lợi trong đường ruột của trẻ ( đường ruột ở trẻ sơ sinh là vô khuẩn, nhưng vi khuẩn đến qua việc nuốt). Nhắc lại chương 1 Hệ vi khuẩn, vi sinh vật hay hệ thực vật được cho là góp phần vào sức khỏe đường ruột trong suốt cuộc đời, cũng như sự hiện diện của hệ miễn dịch. ( Bảng 2-3: thực vật: nước mắt và khí) Polysaccharides được cấu tạo từ hàng nghìn phân tử glucose, liên kết bởi nhiều cách khác nhau, kết quả tạo thành nhiều cấu trúc khác nhau (hình 2-6). Tinh bột là chuỗi phân nhánh của glucose và được cung cấp bởi các tế bào thực vật để dự trữ năng lượng. khoai tây, gạo, ngô và lúa mì đều là nguồn tinh bột hữu ích. Gần như mọi nền văn hóa của con người đều học được cách gieo trồng vụ mùa chính là nguồn cung cấp năng lượng. chúng ta tiêu thụ tinh bột như là một phần của bánh mì, mì ống, bánh pizza, mì tôm, khoai tây chiên Pháp, và bánh bao, cũng như bánh qui, bánh ngọt và bánh nướng. con người có những enzym tiêu hóa chúng cắt đứt các liên kết của tinh bột, giải phóng glucose. Glucose sau đó được hấp thu, và được tế bào sử dụng để sản xuất ATP. Glycogen, là chuỗi phân nhánh bậc cao của glucose, là dạng dự trữ glucose trong cơ thể người. sau bữa ăn giàu cacbonhydrat, lượng đường máu tăng lên. Nếu tăng cao kéo dài, glucose sẽ bị mất đi bởi thận bài tiết vào nước tiểu ( đây là những gì xảy ra trong bệnh đái tháo đường). nhưng với sự có mặt của hoocmon insulin, glucose dư thừa sẽ nhanh chóng được chuyển đổi thành glycogen, và được lưu trữ ở gan và hệ cơ xương. Khi lượng glucose giảm xuống giữa các bữa ăn, glycogen biến đổi lại thành glucose, và giải phóng vào máu ( những phản ứng này được điều chỉnh bởi các hoocmon khác). Lượng đường trong. máu luôn được giữ trong giới hạn bình thường, và các tế bào có thể sử dụng chúng để tổng hợp năng lượng. Cellulose là chuỗi gần như thẳng của glucose được tổng hợp từ tế bào thực vật như một phần của lớp vỏ của chúng. Chúng ta không có enzyme tiêu hóa cellulose chúng ta tiêu thụ một phần của rau ( như đậu, bông cải xanh và đậu hà lan), ngũ cốc và các loại hạt, vì vậy nó không bị biến đổi khi đi qua đường tiêu hóa. Nhiều loại rau sống và các loại hạt, chẳng hạn như cà rốt hoặc quả óc chó, giòn; những gì chúng ta đang gặm đều là cenllulose. Ngay cả những loại hoa quả không đặc biệt giòn, như đào hoặc dâu tây, cũng chứa khá nhiều cellulose. Tên gọi khác cho chế độ ăn của cenllulose là chất xơ, và mặc dù chúng ta không thể sử dụng nó tạo glucose cung cấp năng lượng, thì nó vẫn có chức năng riêng. Chất xơ tạo thành các khoang bên trong ruột già. Điều này nâng cao hiệu quả của nhu động ruột, từng đợt co bóp đẩy các chất chưa tiêu hóa được qua đại tràng. Một chế độ ăn ít chất xơ không cung cấp nhiều bài tập cho đại tràng, và mô cơ đại tràng sẽ co bóp yếu đi, giống như hệ cơ xương của chúng ta sẽ trở nên mềm yếu mà không có tập luyện. một bữa ăn giàu chất xơ sẽ cung cấp các bài tập cho cơ đại tràng và có thể giúp ngăn chặn táo bón mãn tính. Chất xơ cũng là nguồn thức ăn cho hệ vi khuẩn đường ruột của chúng ta, chúng có enzyme phá vỡ những cacbonhydrat phức tạp này. Cấu trúc và chức năng của cacbonhydrat được tóm tắt trong bảng 2-3.
Lactose được cấu tạo từ 1 glucose và 1 galactose, nó được tìm thấy trong sữa,kem,sữa chua và các sản phẩm sữa khác. Đường ngủ cốc maltose được tạo bởi 2 phân tử glucose. Đường đôi trong thức ăn của chúng ta được tiêu hóa thành các đường đơn để sau đó sử dụng cho sản xuất năng lượng. Tiền tố oligo có nghĩa làmột ít; oligosaccharides gồm 3 đến 20 monosaccharide. Không như các cacbodydrates khác, các oligo không là nguồn năng lượng cho chúng ta vì ta không thể tiêu hóa chúng. Trong tế bào người, các oligo được tìm thấy trên bề mặt ngoài màng tế bào. ở đây chúng đáp ứng như là các kháng nguyên là các yếu tố hóa học hoặc là dấu hiệu chỉ điểm (signposts) để nhận diện tế bào. Nhóm máu A.B và AB,ví dụ, là kết quả của các kháng nguyên oligosaccharide trên bề mặt ngoài màng tế bào máu. Tất cả các tế bào của chúng ta đều có các tự kháng nguyên, đê nhận diện các tế bào thuộc từng cá thể.Sự có mặt của các tự kháng nguyên trên các tế bào chủ của chúng ta cung cấp 1 sự so sánh cho các tế bào bạch cầu của hệ thống miễn dịch để sử dụng với các vật liệu lạ, các tế bào bạch cầu có thể tiếp tục nhận ra các kháng nguyên không phải là các tự kháng nguyên. Những kháng nguyên khác bao gồm vi khuẩn,vi rút, và miễn dịch sẽ là chủ đề chính trong chương 14. Các oligosaccarit khác nhau được sản xuất bởi các tế bào tuyến vú và trở thành một phần của sữa mẹ. những cacbonhydrat không phải là nguồn nuôi dưỡng của trẻ sơ sinh đang bú sữa mẹ ( sữa chứa lactose cho em bé) mà là khuyến khích sự sinh trưởng của hệ vi khuẩn có lợi trong đường ruột của trẻ ( đường ruột ở trẻ sơ sinh là vô khuẩn, nhưng vi khuẩn đến qua việc nuốt). Nhắc lại chương 1 Hệ vi khuẩn, vi sinh vật hay hệ thực vật được cho là góp phần vào sức khỏe đường ruột trong suốt cuộc đời, cũng như sự hiện diện của hệ miễn dịch. ( Bảng 2-3: thực vật: nước mắt và khí) Polysaccharides được cấu tạo từ hàng nghìn phân tử glucose, liên kết bởi nhiều cách khác nhau, kết quả tạo thành nhiều cấu trúc khác nhau (hình 2-6). Tinh bột là chuỗi phân nhánh của glucose và được cung cấp bởi các tế bào thực vật để dự trữ năng lượng. khoai tây, gạo, ngô và lúa mì đều là nguồn tinh bột hữu ích. Gần như mọi nền văn hóa của con người đều học được cách gieo trồng vụ mùa chính là nguồn cung cấp năng lượng. chúng ta tiêu thụ tinh bột như là một phần của bánh mì, mì ống, bánh pizza, mì tôm, khoai tây chiên Pháp, và bánh bao, cũng như bánh qui, bánh ngọt và bánh nướng. con người có những enzym tiêu hóa chúng cắt đứt các liên kết của tinh bột, giải phóng glucose. Glucose sau đó được hấp thu, và được tế bào sử dụng để sản xuất ATP. Glycogen, là chuỗi phân nhánh bậc cao của glucose, là dạng dự trữ glucose trong cơ thể người. sau bữa ăn giàu cacbonhydrat, lượng đường máu tăng lên. Nếu tăng cao kéo dài, glucose sẽ bị mất đi bởi thận bài tiết vào nước tiểu ( đây là những gì xảy ra trong bệnh đái tháo đường). nhưng với sự có mặt của hoocmon insulin, glucose dư thừa sẽ nhanh chóng được chuyển đổi thành glycogen, và được lưu trữ ở gan và hệ cơ xương. Khi lượng glucose giảm xuống giữa các bữa ăn, glycogen biến đổi lại thành glucose, và giải phóng vào máu ( những phản ứng này được điều chỉnh bởi các hoocmon khác). Lượng đường trong. máu luôn được giữ trong giới hạn bình thường, và các tế bào có thể sử dụng chúng để tổng hợp năng lượng. Cellulose là chuỗi gần như thẳng của glucose được tổng hợp từ tế bào thực vật như một phần của lớp vỏ của chúng. Chúng ta không có enzyme tiêu hóa cellulose chúng ta tiêu thụ một phần của rau ( như đậu, bông cải xanh và đậu hà lan), ngũ cốc và các loại hạt, vì vậy nó không bị biến đổi khi đi qua đường tiêu hóa. Nhiều loại rau sống và các loại hạt, chẳng hạn như cà rốt hoặc quả óc chó, giòn; những gì chúng ta đang gặm đều là cenllulose. Ngay cả những loại hoa quả không đặc biệt giòn, như đào hoặc dâu tây, cũng chứa khá nhiều cellulose. Tên gọi khác cho chế độ ăn của cenllulose là chất xơ, và mặc dù chúng ta không thể sử dụng nó tạo glucose cung cấp năng lượng, thì nó vẫn có chức năng riêng. Chất xơ tạo thành các khoang bên trong ruột già. Điều này nâng cao hiệu quả của nhu động ruột, từng đợt co bóp đẩy các chất chưa tiêu hóa được qua đại tràng. Một chế độ ăn ít chất xơ không cung cấp nhiều bài tập cho đại tràng, và mô cơ đại tràng sẽ co bóp yếu đi, giống như hệ cơ xương của chúng ta sẽ trở nên mềm yếu mà không có tập luyện. một bữa ăn giàu chất xơ sẽ cung cấp các bài tập cho cơ đại tràng và có thể giúp ngăn chặn táo bón mãn tính. Chất xơ cũng là nguồn thức ăn cho hệ vi khuẩn đường ruột của chúng ta, chúng có enzyme phá vỡ những cacbonhydrat phức tạp này. Cấu trúc và chức năng của cacbonhydrat được tóm tắt trong bảng 2-3.
LIPIDS
Lipids bao gồm các nguyên tử cacbon, hidro, và oxi; đôi khi có cả nguyên tử photpho. Nhóm hợp chất hữu cơ này bao gồm nhiều dạng chất khác nhau với nhiều chức năng khác nhau. Chúng tôi sẽ trình bày 3 dạng: chất béo thực sự, photpholipid và steroid (hình 2-7).
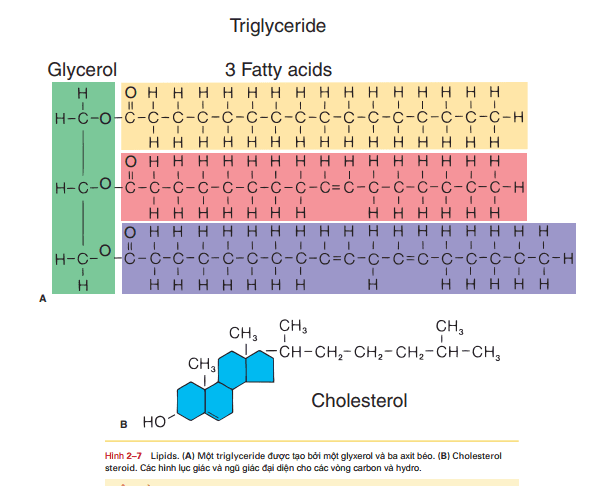
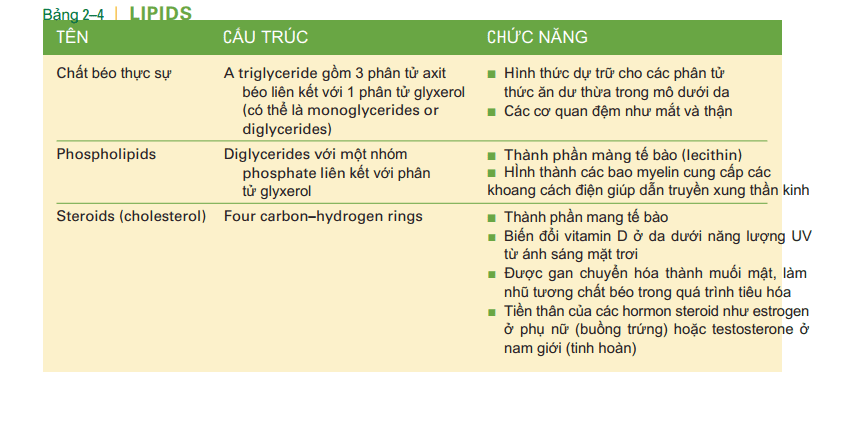
Chất béo thực sự (hay còn gọi là chất béo trung tính) được tạo thành từ một phân tử glixerol với một, hai, hoặc ba phân tử axit béo. Glixerol là một phân tử nhỏ với 3 nguyên tủ cacbon. Axít béo là một phân tử dài có số nguyên tử cacbon, từ 12 đến 24, được liên kết với hydro, với nhóm carbon đầu tiên là nhóm cacboxyl: COOH. Nếu cả 3 phân tử axit béo liên kết với một phân tử glixerol, một triglixerid được hình thành, hai axit béo thì gọi là diglixerid và một axit béo thì gọi là monoglixerid. Axit béo trong chất béo thực sự có thể đã bão hòa hoặc chưa bão hòa. Nhìn vào bảng 2-7 và thấy rằng những axit béo mà các nguyên tử cacbon liên kết với nhau bởi những liên kết đơn. Mỗi nguyên tử cacbon liên kết với tối đa các nguyên tử hidro; đó chính là axit béo bão hòa, có nghĩa là bão hòa số nguyên tử hidro. Các axit béo khác trong công thức cấu tạo chứa một hay nhiều hơn những liên kết đôi giữa các nguyên tử cacbon và số lượng nguyên tử hidro chưa đạt tối đa, đó là những axit béo chưa bão hòa. Rất nhiều triglixerid chứa cả axit béo bão hòa và chưa bão hòa, và mặc dù chưa thật chính xác, thì đó thường dễ hơn để nói về sự bão hòa hay chưa bão hòa của chất béo, cho thấy sự ưu thế của các loại chất béo khác nhau. Ở nhiệt độ phòng, các chất béo bão hòa thường tồn tại ở dạng dung dịch, trong khi đó chất béo chưa bão hòa lại thường (không phải luôn luôn) ở dạng lỏng. chất béo bão hòa thường được tìm thấy trong thức ăn có nguồn gốc động vật như thị bò, thịt lợn, thịt gà, trứng và phô mai, nhưng dầu lạc và dầu dừa cũng đều là các chất béo bão hòa. chất béo không bão hòa được tìm thấy trong các loại dầu thực vật khác như dầu ngô, dầu hướng dương và dầu cây rum, nhưng một số loại dầu cá nhất định cũng không bão hòa, và thậm chí thịt lợn có chứa một số axit béo chưa bão hòa. Chất béo chưa bão hòa có thể chuyển thành chất béo bão hòa để mang lại kiểu dáng hay hương vị dễ chịu hơn cho các loại thức ăn đóng gói, hay bảo quản lâu hơn mà không phải để tủ lạnh ( hạn sử dụng dài hơn). Những chất béo chưa bão hòa được hidro hóa ( có nghĩa là nhận thêm hidro) được gọi là chất béo chuyển hóa. Chúng góp phần đáng kể gây nên xơ vữa động mạch; có nghĩa là các phân tử cholesterol bất thường sẽ ngày càng bám vào long mạch gây nên tắc nghẽn động mạch, đặc biệt là động mạch vành tim. Tính đến đầu năm 2014, Cơ quan Quản lý Thực phẩm và Dược phẩm đang xem xét cấm việc sử dụng chất béo chuyển hóa trong thực phẩm chế biến sẵn. (Xem thêm bảng 2-4: Lipid máu.) Các triglixerid là một hình thức lưu trữ thức ăn còn dư; có nghĩa là chúng dự trũ năng lượng (năng lượng tiềm tang). Bất kỳ loại thực phẩm nào tiêu thụ vượt quá nhu cầu calo của cơ thể sẽ được chuyển thành chất béo và được lưu trữ trong mô mỡ. Hầu hết các mô mỡ là dưới da, giữa da và cơ bắp. Tuy nhiên, một số cơ quan như mắt và thận, được bao bọc trong một lớp mỡ hoạt động như một lớp đệm để hấp thụ sốc. (Chúng tôi sẽ trình bày các chức năng khác của mô mỡ trong Chương 4.) Phospholipid là diglycerides với một nhóm phosphate (PO4) ở vị trí thứ ba của glycerol. Mặc dù có cấu trúc tương tự với chất béo thực sự, phospholipid không phải là nguồn năng lượng dự trữ mà là thành phần cấu trúc của tế bào. Lecithin là một phospholipid cũng là một phần của màng tế bào của chúng ta (xem Hình 3-1 trong Chương 3, mỗi phân tử phospholipid trông giống như một quả cầu có hai đuôi; quả cầu là glycerol và phosphate, đuôi là hai axit béo). Một phospholipid khác là myelin, là những gì bao quanh các tế bào thần kinh tạo thành các bao myelin và cung cấp các khoảng cách điện để dẫn truyền xung thần kinh. Steroid được cấu trúc từ các thành phần lipid khác nhau. Cholesterol là một loại steroid quan trọng; nó được cấu tạo bởi bốn vòng carbon và hydro (không axit béo và glycerol) và được thể hiện trong hình 2-7. Gan tự tổng hợp nên cholesterol, ngoài cholesterol cung cấp từ thực phẩm. Chỉ thức ăn động vật như thịt bò, thịt lợn, các sản phẩm từ sữa và lòng đỏ trứng mới chứa cholesterol. Người ăn chay không có cholesterol trong chế độ ăn uống của họ và cholesterol phụ thuộc vào sự tổng hợp của gan. Cholesterol còn là thành phần quan trọng của màng tế bào và là tiền chất cho sự tổng hợp các steroid khác. Trong buồng trứng hoặc tinh hoàn, cholesterol được sử dụng để tổng hợp các hormon steroid estrogen hoặc testosterone, tương ứng. Một dạng cholesterol trong da bị biến đổi thành vitamin D khi tiếp xúc với ánh sáng mặt trời. Tế bào gan sử dụng cholesterol để tổng hợp muối mật, nhũ hóa chất béo trong quá trình tiêu hóa. Mặc dù chúng gây nên các bệnh mạch vành và các cơn đau tim, cholesterol vẫn là một chất cần thiết cho con người. Cấu trúc và chức năng của lipid được tóm tắt trong Bảng 2-4.
PROTEINS
Protein được cấu tạo từ các tiểu đơn vị hay các khối đơn vị được gọi là các axit amin, những cái mà tất cả chúng đều chứa các nguyên tử cacbon, hidro, oxi và nito. Một số axit amin chứa cả lưu huỳnh, cho phép hình thành liên kết disulfide trong các protein như insulin và kháng thể. Có khoảng 20 axit amin tạo nên protein của con người. Chúng tôi tìm thấy các axit amin này từ các protein động vật như thịt bò, gà, thịt lợn và cá, và từ các protein thực vật như trong đậu, đậu Hà Lan, quả hạch, ngô và các loại ngũ cốc khác. Cấu trúc của các axit amin được thể hiện trong hình 2-8,
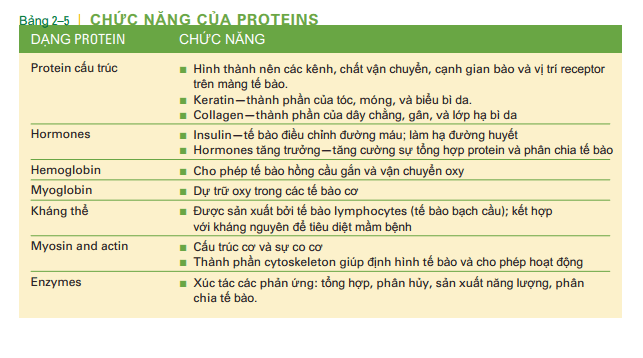
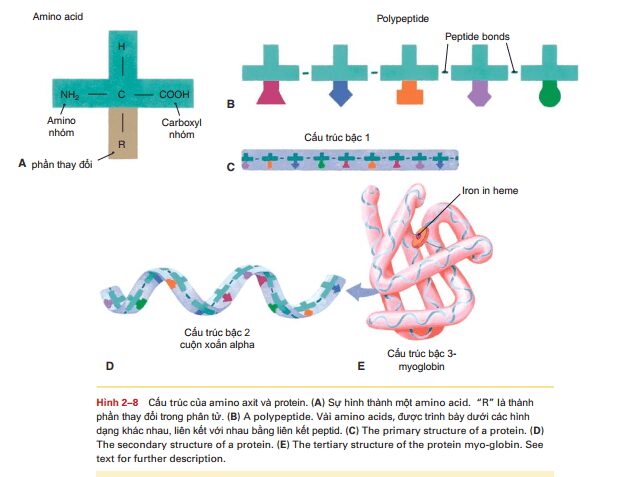 và bạn sẽ nhận thấy rằng tất cả chúng đều có một số điểm chung. Mỗi axit amin có một nguyên tử cacbon trung tâm liên kết cộng hóa trị với một nguyên tử hydro, một nhóm amin (NH2), và một nhóm cacboxyl (COOH). Tại liên kết thứ tư của nguyên tử carbon trung tâm là phần thay đổi của axit amin, đại diện bởi R. Nhóm R có thể là một hydro đơn nguyên tử hoặc nhóm CH3 hoặc cấu hình phức tạp hơn carbon và hydro và có lẽ là lưu huỳnh. Điều này cho phép mỗi trong số 20 axit amin hơi khác nhau về dạng thù hình. Hai axit amin liên kết với nhau bởi một liên kết peptit, và chuỗi ngắn các axit amin liên kết với nhau bởi liên kết peptid được gọi là polypeptide. Một protein có thể chứa từ 50 đến hàng nghìn axit amin. Trình tự của các axit amin là cụ thể và duy nhất cho mỗi protein và được gọi là cấu trúc bậc một. Trình tự duy nhất này và các liên kết hydro và các liên kết disulfide được hình thành trong chuỗi axit amin, xác định cách protein sẽ xoắn như thế nào để hoàn thành tổng hợp. Việc xoắn có thể đơn giản, một xoắn (cuộn) hoặc một nếp gấp được gọi là cấu trúc bậc hai, hoặc nhiều kiểu gấp nếp phức tạp có thể xảy ra để tạo thành một protein hình cầu được gọi là cấu trúc bậc. Myoglobin, được tìm thấy trong cơ, là một dạng protein hình cầu (Hình 2-8E). Khi hoàn thành, mỗi protein có cấu trúc ba chiều đặc trưng, quy định chức năng của protein. Một số protein gồm nhiều hơn một chuỗi axit amin (bậc bốn kết cấu). Ví dụ như hemoglobin có bốn chuỗi axit amin (xem bảng 3-2 trong Chương 3). Lưu ý rằng myoglobin chứa một nguyên tử sắt (một phân tử hemoglobin có bốn nguyên tử sắt). Một số protein đòi hỏi một nguyên tố vi lượng chẳng hạn như sắt hoặc kẽm để hoàn thành cấu trúc và đảm bảo hoạt động chức năng của chúng. Protein trong cơ thể chúng ta có rất nhiều chức năng, một số đã được trình bày ở bảng 2-5 và sẽ được nhắc lại nữa ở các chương sau. Mặc dù chúng ta thường không nghĩ rằng protein như một nguồn năng lượng, nếu chế độ ăn của chúng ta có nhiều axit amin cần thiết cho sự tổng hợp protein, thậm chí là nhiều hơn, thì lượng dư thừa đó sẽ được chuyển hóa thành các cacbonhydrat đơn giản, hay thậm chí tạo thành các chất béo, được dự trữ như dạng năng lượng tiềm tàng. ( xem bảng 2-5 Bí ẩn về Protein: thảo luận về các protein gây bệnh.) một chức năng vô cùng quan trọng của protein sẽ được trình bày ngay dưới đây, đó là enzyme.
và bạn sẽ nhận thấy rằng tất cả chúng đều có một số điểm chung. Mỗi axit amin có một nguyên tử cacbon trung tâm liên kết cộng hóa trị với một nguyên tử hydro, một nhóm amin (NH2), và một nhóm cacboxyl (COOH). Tại liên kết thứ tư của nguyên tử carbon trung tâm là phần thay đổi của axit amin, đại diện bởi R. Nhóm R có thể là một hydro đơn nguyên tử hoặc nhóm CH3 hoặc cấu hình phức tạp hơn carbon và hydro và có lẽ là lưu huỳnh. Điều này cho phép mỗi trong số 20 axit amin hơi khác nhau về dạng thù hình. Hai axit amin liên kết với nhau bởi một liên kết peptit, và chuỗi ngắn các axit amin liên kết với nhau bởi liên kết peptid được gọi là polypeptide. Một protein có thể chứa từ 50 đến hàng nghìn axit amin. Trình tự của các axit amin là cụ thể và duy nhất cho mỗi protein và được gọi là cấu trúc bậc một. Trình tự duy nhất này và các liên kết hydro và các liên kết disulfide được hình thành trong chuỗi axit amin, xác định cách protein sẽ xoắn như thế nào để hoàn thành tổng hợp. Việc xoắn có thể đơn giản, một xoắn (cuộn) hoặc một nếp gấp được gọi là cấu trúc bậc hai, hoặc nhiều kiểu gấp nếp phức tạp có thể xảy ra để tạo thành một protein hình cầu được gọi là cấu trúc bậc. Myoglobin, được tìm thấy trong cơ, là một dạng protein hình cầu (Hình 2-8E). Khi hoàn thành, mỗi protein có cấu trúc ba chiều đặc trưng, quy định chức năng của protein. Một số protein gồm nhiều hơn một chuỗi axit amin (bậc bốn kết cấu). Ví dụ như hemoglobin có bốn chuỗi axit amin (xem bảng 3-2 trong Chương 3). Lưu ý rằng myoglobin chứa một nguyên tử sắt (một phân tử hemoglobin có bốn nguyên tử sắt). Một số protein đòi hỏi một nguyên tố vi lượng chẳng hạn như sắt hoặc kẽm để hoàn thành cấu trúc và đảm bảo hoạt động chức năng của chúng. Protein trong cơ thể chúng ta có rất nhiều chức năng, một số đã được trình bày ở bảng 2-5 và sẽ được nhắc lại nữa ở các chương sau. Mặc dù chúng ta thường không nghĩ rằng protein như một nguồn năng lượng, nếu chế độ ăn của chúng ta có nhiều axit amin cần thiết cho sự tổng hợp protein, thậm chí là nhiều hơn, thì lượng dư thừa đó sẽ được chuyển hóa thành các cacbonhydrat đơn giản, hay thậm chí tạo thành các chất béo, được dự trữ như dạng năng lượng tiềm tàng. ( xem bảng 2-5 Bí ẩn về Protein: thảo luận về các protein gây bệnh.) một chức năng vô cùng quan trọng của protein sẽ được trình bày ngay dưới đây, đó là enzyme.
Enzymes
Enzymes là chất xúc tác, có nghĩa là chúng đẩy nhanh các phản ứng hóa học mà không cần đến nguồn năng lượng từ bên ngoài như nhiệt.Nhiều phản ứng diễn ra trong cơ thể được xúc tác bởi các enzyme cụ thể; tất cả các phản ứng này phải diễn ra ở nhiệt độ cơ thể. Cách mà enzyme hoạt động như chất xúc tác được gọi là nguyên lý hoạt động. Hãy nhớ rằng nguyên lý không phải là dự đoán; một lý thuyết khoa học là giải thích tốt nhất cho tất cả các bằng chứng có sẵn. Tất cả bằng chứng hoạt động của enzyme hỗ trợ cho nguyên lý hoạt động, trong đó nói rằng cấu trúc của một enzyme xác định chức năng của nó. Chức năng cụ thể cũng bao gồm hình dạng của các phân tử phản ứng, được gọi là chất nền.Một phản ứng tổng hợp đơn giản được mô tả trong hình 2-9A. Lưu ý rằng mỗi enzyme có một hình dạng cụ thể, giống như các phân tử chất nền. Điểm hoạt hóa enzyme là vị trí mà enzyme gắn với một phần trên hình dạng của chất nền. Các chất nền phải vừa với vị trí hoạt hóa của enzyme, và các liên kết tạm thời có thể hình thành giữa enzyme và chất nền. Đây được gọi là phức hợp enzyme-chất nền. Trong trường hợp, hai phân tử chất nền mang lại gần nhau để liên kết hóa học hình thành giữa chúng, tạo ra một hợp chất mới. Các sản phẩm của phản ứng, các hợp chất mới, sau đó được giải phóng, còn bản thân enzyme không thay đổi và có thể xúc tác cho một phản ứng cùng loại khác. Phản ứng trong hình 2-9B là phản ứng phân hủy. Giống như khi phân tử chất nền liên kết với vị trí hoạt hóa của enzyme, làm biến dạng các liên kết bên trong của nó, đứt gãy, tạo thành hai phân tử sản phẩm và enzyme vẫn không bị biến đổi cấu trúc. Mỗi enzyme cụ thể sẽ chỉ xúc tác cho một loại phản ứng.
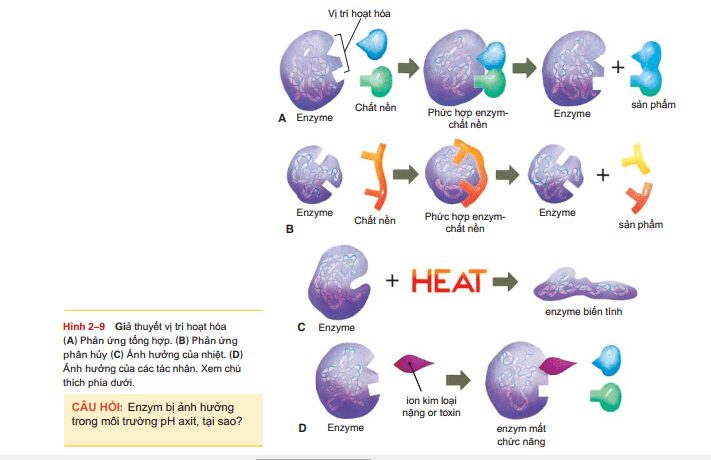 Ví dụ như một loại enzyme tiêu hóa protein trong thực phẩm có hình dạng thích hợp để xảy ra phản ứng nhưng lại không thể tiêu hóa tinh bột. Để tiêu hóa tinh bột, cần có loại enzyme khác với vị trí hoạt hóa khác hoàn toàn. Hàng nghìn phản ứng hóa học diễn ra trong cơ thể, và do đó chúng ta có hàng ngàn enzyme, mỗi loại có hình dạng và vị trí hoạt hóa riêng biệt. Khả năng hoạt động của enzyme có thể bị giới hạn hoặc bị phá hủy bởi những thay đổi trong chất lỏng nội bào hay ngoại bào mà chúng được tìm thấy. Thay đổi pH và nhiệt độ đặc biệt quan trọng. Nhớ lại rằng độ pH của chất lỏng nội bào là khoảng 6,8 đến 7,0 và pH giảm có nghĩa là có nhiều ion H + hơn. Nếu pH giảm đáng kể, các ion H + dư thừa sẽ phản ứng với các vị trí hoạt hóa của các enzym tế bào, thay đổi hình dạng và ngăn chúng xúc tác phản ứng. Điều này là lý do tại sao tình trạng nhiễm toan có thể làm chết tế bào – enzyme của các tế bào không thể hoạt động đúng. nhiệt độ cơ thể: 97 ° đến 99 ° F (36 ° đến 38 ° C). Nhiệt độ 106 ° F, sốt cao, có thể làm gãy các liên kết hóa học duy trì hình dạng của các enzym (xem Hình 29C). Nếu một enzyme mất hình dạng của nó, sẽ trở nên biến tính, và một enzyme biến tính không thể hoạt động như một chất xúc tác. Một số enzyme của con người, khi bị biến tính do sốt cao, có thể trở lại hình dạng ban đầu của chúng nếu sốt hạ xuống nhanh chóng. Tuy nhiên, những enzym khác, sẽ không. (Một ví dụ về sự thay đổi không thể trở lại như ban đầu là trứng luộc chín; các protein trong lòng trắng trứng và lòng đỏ sẽ không bao giờ trở lại những gì chúng có trong trứng ban đầu.) Sốt cao có thể gây tổn thương não hoặc tử vong do các enzym trong não đã hoàn toàn biến tính. Bạn đã biết rằng các kim loại như chì và thủy ngân có hại cho con người và cả hai có thể gây tổn thương nghiêm trọng cho hệ thần kinh và các mô cơ thể khác. Những kim loại nặng này có hại cho chúng ta vì chúng phản ứng rất mạnh mẽ và ngăn chặn hoạt động của các enzym của chúng ta. Hình. 29D mô tả những gì xảy ra. Lưu ý rằng các liên kết ion kim loại nặng với một phần của vị trí hoạt động của enzyme và thay đổi hình dạng của nó. Các phân tử chất nền không thể phù hợp, và enzyme là vô dụng. Nhiều hóa chất khác độc hại với chúng ta vì cùng lý do: Chúng phá hủy chức năng của các enzym của chúng ta, và các phản ứng thiết yếu không thể xảy ra.
Ví dụ như một loại enzyme tiêu hóa protein trong thực phẩm có hình dạng thích hợp để xảy ra phản ứng nhưng lại không thể tiêu hóa tinh bột. Để tiêu hóa tinh bột, cần có loại enzyme khác với vị trí hoạt hóa khác hoàn toàn. Hàng nghìn phản ứng hóa học diễn ra trong cơ thể, và do đó chúng ta có hàng ngàn enzyme, mỗi loại có hình dạng và vị trí hoạt hóa riêng biệt. Khả năng hoạt động của enzyme có thể bị giới hạn hoặc bị phá hủy bởi những thay đổi trong chất lỏng nội bào hay ngoại bào mà chúng được tìm thấy. Thay đổi pH và nhiệt độ đặc biệt quan trọng. Nhớ lại rằng độ pH của chất lỏng nội bào là khoảng 6,8 đến 7,0 và pH giảm có nghĩa là có nhiều ion H + hơn. Nếu pH giảm đáng kể, các ion H + dư thừa sẽ phản ứng với các vị trí hoạt hóa của các enzym tế bào, thay đổi hình dạng và ngăn chúng xúc tác phản ứng. Điều này là lý do tại sao tình trạng nhiễm toan có thể làm chết tế bào – enzyme của các tế bào không thể hoạt động đúng. nhiệt độ cơ thể: 97 ° đến 99 ° F (36 ° đến 38 ° C). Nhiệt độ 106 ° F, sốt cao, có thể làm gãy các liên kết hóa học duy trì hình dạng của các enzym (xem Hình 29C). Nếu một enzyme mất hình dạng của nó, sẽ trở nên biến tính, và một enzyme biến tính không thể hoạt động như một chất xúc tác. Một số enzyme của con người, khi bị biến tính do sốt cao, có thể trở lại hình dạng ban đầu của chúng nếu sốt hạ xuống nhanh chóng. Tuy nhiên, những enzym khác, sẽ không. (Một ví dụ về sự thay đổi không thể trở lại như ban đầu là trứng luộc chín; các protein trong lòng trắng trứng và lòng đỏ sẽ không bao giờ trở lại những gì chúng có trong trứng ban đầu.) Sốt cao có thể gây tổn thương não hoặc tử vong do các enzym trong não đã hoàn toàn biến tính. Bạn đã biết rằng các kim loại như chì và thủy ngân có hại cho con người và cả hai có thể gây tổn thương nghiêm trọng cho hệ thần kinh và các mô cơ thể khác. Những kim loại nặng này có hại cho chúng ta vì chúng phản ứng rất mạnh mẽ và ngăn chặn hoạt động của các enzym của chúng ta. Hình. 29D mô tả những gì xảy ra. Lưu ý rằng các liên kết ion kim loại nặng với một phần của vị trí hoạt động của enzyme và thay đổi hình dạng của nó. Các phân tử chất nền không thể phù hợp, và enzyme là vô dụng. Nhiều hóa chất khác độc hại với chúng ta vì cùng lý do: Chúng phá hủy chức năng của các enzym của chúng ta, và các phản ứng thiết yếu không thể xảy ra.
NUCLEIC ACIDS
DNA and RNA
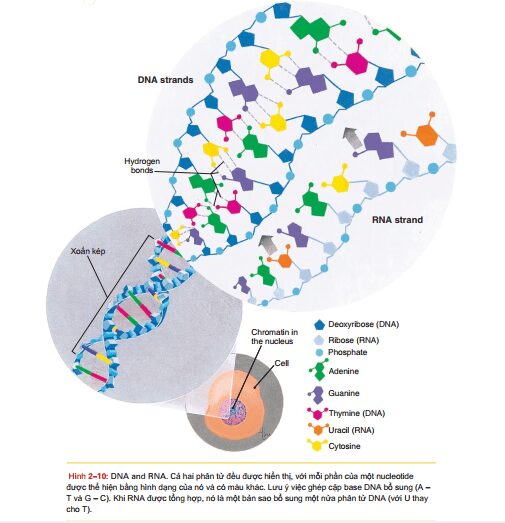
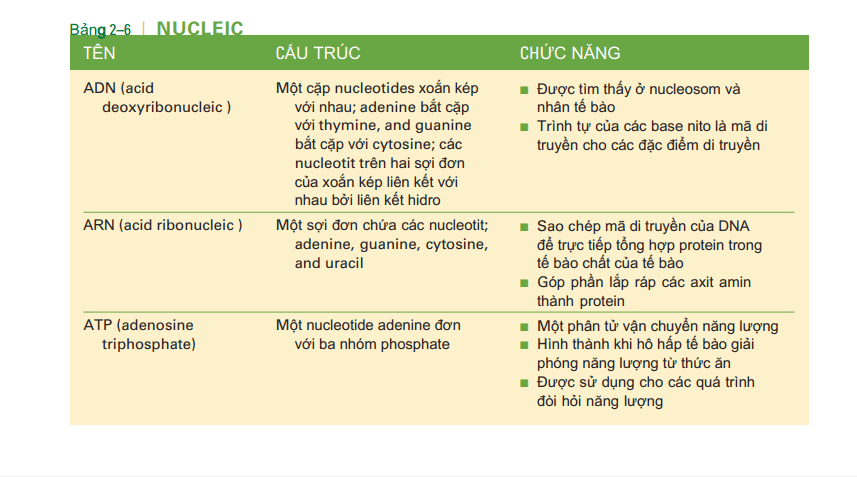
Các axit nucleic, DNA (axit deoxyribonucleic) và RNA (axit ribonucleic), là các phân tử lớn được tạo thành từ các tiểu đơn vị nhỏ hơn được gọi là nucleotide. Một nucleotide bao gồm một đường pentose, một nhóm phosphate, và một trong một số cơ sở nitơ. Trong nucleotide DNA, đường là deoxyribose, và các base là adenine, guanine, cytosine, hoặc thymine. Trong nucleotide RNA, đường là ribose, và các base là adenine, guanine, cytosine, hoặc uracil. Các phân tử DNA và RNA được thể hiện trong hình 210. Chú ý rằng DNA trông hơi giống một cái thang xoắn; cái thang này gồm hai sợi nucleotide được gọi là xoắn kép (hai cuộn dây). Các phân tử phosphat và đường thay thế tạo thành khung của thang, và các cặp base nitơ tạo thành các bậc thang. Kích thước của các bazơ và số lượng liên kết hiđrô có thể tạo thành các cặp liên kết bổ sung của các axit nucleic. Trong DNA, adenine luôn được ghép nối với thymine (với hai liên kết hydro), và guanine luôn được ghép nối với cytosine (với ba liên kết hydro). DNA tạo nên nhiễm sắc thể của tế bào và là mã di truyền cho các đặc điểm di truyền.
Trình tự các base trong các sợi DNA gốc là một mã cho nhiều loại protein sinh vật sống; mã giống nhau ở thực vật, động vật khác và vi khuẩn. Trình tự các base cho một protein được gọi là gen. Gen của con người là mã cho các protein được sản xuất bởi các tế bào của con người (mặc dù nhiều gen này cũng được tìm thấy trong tất cả các dạng khác của cuộc sống – tất cả chúng ta đều có liên quan rất nhiều). Chức năng của DNA sẽ được trình bày chi tiết hơn trong chương tiếp theo.
RNA thường là một chuỗi nucleotit đơn (xem hình 210), với các nucleotide uracil thay cho nucleotide thymine. RNA được tổng hợp từ DNA trong nhân của một tế bào, và có một số hình thức. Tất cả đều thực hiện chức năng của chúng trong tế bào chất. RNA sao chép mã di truyền từ DNA và giúp tổng hợp các axit amin thành protein. Tổng hợp protein cũng sẽ được thảo luận trong chương sau.
ATP
ATP (adenosine triphosphate) là một nucleotide chuyên biệt bao gồm base adenine, đường ribose và ba nhóm phosphate (xem Hình 211). Kể ra sự hình thành của ATP như là một sản phẩm hô hấp tế bào có chứa năng lượng hữu ích sinh học. ATP là một trong nhiều phân tử vận chuyển năng lượng trong tế bào, chuyển năng lượng tiềm năng trong thức ăn thành các quá trình tế bào. Khi một phân tử glucose được phân hủy thành carbon dioxide và nước với sự giải phóng năng lượng, tế bào sử dụng một số năng lượng này để tổng hợp ATP. Hiện tại trong tế bào là các phân tử ADP (adenosine diphosphate) và các nhóm phosphate miễn phí. Năng lượng giải phóng từ glucose được sử dụng để liên kết lỏng một phosphate thứ ba với ADP, tạo thành ATP (di chuyển sang phải trong hình 211).
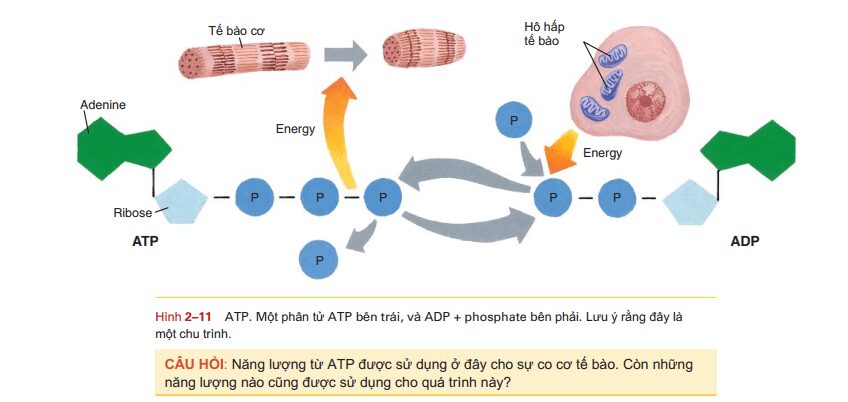
Khi liên kết của phosphate thứ ba này bị phá vỡ và năng lượng được giải phóng (di chuyển sang trái sang phải trong hình 2-11), ATP sau đó trở thành nguồn năng lượng cho các quá trình tế bào như mitosis, co cơ, hoặc tổng hợp protein cho sự tăng trưởng và sửa chữa . Tất cả các tế bào đều có enzyme có thể loại bỏ nhóm phosphate thứ ba từ ATP để giải phóng năng lượng của nó, hình thành ADP và phosphate. Khi hô hấp tế bào tiếp tục, ATP được tổng hợp lại từ ADP và phosphate. Sự hình thành ATP để giải phóng năng lượng từ thức ăn và sự phân hủy ATP để giải phóng năng lượng cho các quá trình tế bào là một chu kỳ tiếp tục trong các tế bào. Cấu trúc và chức năng của axit nucleic được tóm tắt trong Bảng 2-6.
TỔNG KẾT
Hóa chất có thể vô cơ, chẳng hạn như nước, oxy và sắt, hoặc hữu cơ, chẳng hạn như carbohydrate, chất béo, protein và axit nucleic. Tất cả các hóa chất chúng ta vừa mô tả được coi là không sống, mặc dù chúng là những phần thiết yếu của tất cả các sinh vật sống. Các tế bào của cơ thể chúng ta là sự sắp xếp chính xác của các hóa chất không sống này và được coi là vật chất sống. Do đó, cấp độ tế bào là cấp độ tổ chức tiếp theo mà chúng tôi sẽ kiểm tra.
MỤC TIÊU HỌC TẬP
Nguyên tố
- Các nguyên tố là những hóa chất đơn giản nhất, tạo nên mọi vấn đề.
- Carbon, hydrogen, oxygen, nitrogen, phosphorus, sulfur, and calcium chiếm 99% trọng lượng cơ thể.
- Kết hợp các nguyên tố trong nhiều cách để tạo thành các phân tử, cả vô cơ và hữu cơ.
Nguyên tử (xem Hình. 2–1)
- Nguyên tử là thành phần cấu tạo nhỏ nhất của một nguyên tố và mang tính chất của nguyên tố đó
- Nguyên tử bao gồm các hạt mang điện tích âm và các hạt mang điện tích dương và hạt không mang điện
- Protons mang điện tích dương và được tìm thấy trong hạt nhân của nguyên tử.
- Neutrons không mang điện và có trong hạt nhân nguyên tử.
- Electrons mang điện tích âm và xoay quanh hạt nhân.
- Số lượng và trình tự các electron giúp nguyên tử có khả năng liên kết.
Liên kết hóa học
- Liên kết ion là sự mất đi một electron của một nguyên tử này và sự nhận những electron này bởi những nguyên tử khác: Ions được tạo thành và hút nhau (xem hình 2-9).
- Cations là ions mang điện tích dương: Na+, Ca+2.
- Anions là ions mang điện tích âm: Cl–, HCO3–.
- Muối vô cơ, acids, and bases được tạo thành bời các liên kết ion.
- Trong nước, rất nhiều liên kết ion bị cắt đứt; phân li ra các ion cho các phản ứng khác.
- Liên kết cộng hóa trị là sự dùng chung các electron giữa các nguyên tử (xem Hình. 2–3).
- Oxygen gas (O2) and water (H2O) là các phân tử mang liên kết cộng hóa trị.
- Carbon luôn tạo thành liên kết cộng hóa trí; đó là liên kết cơ bản của hợp chất hữu cơ.
- Liên kết cộng hóa trị không bị yêú đi trong dung dịch.
- Liên kết disulfua là liên kết cộng hóa tri giữa hai nguyên tử lưu huỳnh trong protein; chúng tạo nên các cấu trúc không gian ba chiều của protein như insulin.
- Liên kêt hidro là sự hút nhau giữa các nguyên tử hidro đã liên kết cọng hóa trị (hơi dương) với các nguyên tử oxy và nito gần đó (hơi âm).
- Cấu trúc không gian ba chiều của protein và được hình thành chủ yếu từ liên kết hidro.
- Nước là cấu trúc gắn liền và kết dính bởi có các liên kết hidro
Phản ứng hóa học
- Một sự thay đổi mang lại bởi sự hình thành hoặc phá vỡ các liên kết hóa học.
- Tổng hợp – các liên kết được hình thành để nối hai hay nhiều phân tử.
- Phân hủy các liên kết bị phá vỡ trong một phân tử.
- Với tế bào, các sản phẩm của các phản ứng phân hủy thường được tái chế cho các phản ứng tổng hợp.
Các hợp chất vô cơ quan trọng
- Nước chiếm 55% đến 70% cơ thể.
- Dung môi – để vận chuyển chất dinh dưỡng trong máu và bài tiết chất thải trong nước tiểu.
- Chất bôi trơn – chất nhầy trong đường tiêu hóa.
- Ổn định nhiệt độ-thay đổi nhiệt độ từ từ, ngăn chặn đột ngột thay đổi nhiệt độ cơ thể; hấp thụ nhiệt độ cơ thể trong sự bốc hơi mồ hôi.
- Các khoang chứa nước vị trí của nước trong cơ thể (xem Hình 24).
— Nội bào – bên trong tế bào; 65% tổng lượng nước cơ thể.
— Ngoại bào – 35% tổng lượng nước cơ thể
1) Plasma—trong mạch máu
2) Bạch huyết – trong các mạch bạch huyết.
3) Chất lỏng mô – trong không gian mô giữa các tế bào.
4) Chất lỏng chuyên biệt trong khớp, mắt và hệ thống thần kinh trung ương.
- Oxygen—221% của bầu khí quyển
- Cần thiết cho hô hấp tế bào: sự phân hủy của các phân tử thực phẩm giải phóng năng lượng.
- Carbon dioxide
- Sản xuất như một sản phẩm chất thải của hô hấp tế bào.
- Được thở ra; lượng CO2 dư thừa trong dịch cơ thể gây ra nhiễm toan.
- Hô hấp tế bào: quá trình xử lí cung cấp năng lượng trong tế bào:
- Glucose + O2 → CO2 + H2O + ATP + heat
- Đây là lý do tại sao chúng ta hít thở: để lấy oxy để phá vỡ thức ăn để tạo ra năng lượng, và thở ra khí CO2 được tạo ra.
- Các nguyên tố vi lượng- một lượng nhỏ muối khoáng cần thiết (xem Bảng 2–2).
- Acids, bases, and pH
- Phạm vi pH dao động từ 0 đến 14; 7 là trung tính. Dưới 7 là có tính axit, và trên 7 là kiềm.
- Một axit làm tăng nồng độ ion H + của dung dịch; một bazơ làm giảm nồng độ ion H + (hoặc tăng nồng độ ion OH) (xem Hình 25).
- Phạm vi pH trong các tế bào là khoảng 6,8 đến 7,0. Dải pH bình thường của máu là 7,35 -7,45. Chuyển hóa bình thường có xu hướng làm cho dịch cơ thể có tính axit hơn.
- Hệ thống đệm duy trì pH bình thường bằng cách phản ứng với các axit mạnh hoặc các bazơ mạnh để thay đổi chúng thành các chất không làm thay đổi pH.
- Hệ thống đệm bicarbonate bao gồm NaHCO3 phản ứng với các axit mạnh và H2CO3 để phản ứng với các bazơ mạnh (tỷ lệ khoảng 20: 1).
Các hợp chất hữu cơ quan trọng
- Carbohydrates (xem Bảng 2–3 và hình. 2–6).
- Monosaccharides là các loại đường đơn giản. Glucose, một đường hexose (C6H12O6), là nguồn năng lượng chính để hô hấp tế bào. Fructose và galactose có cùng công thức hóa học.
— Đường Pentose là một phần của các axit nucleic DNA và RNA.
- Disaccharides được tạo thành từ hai đường hexose. Sucrose, lactose và maltose được tiêu hóa thành monosaccharides và được sử dụng để hô hấp tế bào.
- Oligosaccharides bao gồm từ 3 đến 20 monosaccharide
— Trên màng tế bào, chúng là những kháng nguyên xác định các tế bào là tự.
—Trong sữa mẹ, chúng nuôi dưỡng quần thể vi khuẩn đường ruột có lợi cho trẻ sơ sinh. d. Polysaccharides được tạo thành từ hàng nghìn phân tử glucose.
— Các tinh bột là các sản phẩm thực vật được phân hủy trong quá trình tiêu hóa thành glucose.
— Glycogen là dạng trong đó glucose được lưu trữ trong gan và cơ bắp để giúp điều chỉnh lượng đường trong máu..
— Cellulose, chất xơ của tế bào thực vật, không thể tiêu hóa được nhưng lại thúc đẩy nhu động đại tràng đạt hiệu quả hơn.
- Lipids (xem Bảng 2–4 và hình 2–7).
- Chất béo thực sự được làm từ các axit béo và glycerol; chất béo trung tính là một dạng lưu trữ cho năng lượng tiềm năng trong mô mỡ. Mắt và thận được đệm bằng chất béo. Axit béo có thể bão hòa (số lượng tối đa liên kết hydro) hoặc không no (ít hơn số lượng tối đa các liên kết hydro). Chất béo bão hòa và chất béo hydro hóa hoặc trans góp phần gây xơ vữa động mạch.
- Phospholipid là chất diglyceride như lecithin là một phần của màng tế bào. Myelin là một phospholipid cung cấp cách điện cho các tế bào thần kinh.
- Steroid bao gồm bốn vòng carbon và hydro. Cholesterol, được sản xuất bởi gan và được tiêu thụ trong thực phẩm, là loại steroid cơ bản mà từ đó cơ thể sản sinh ra những loại khác: steroid kích thích tố, vitamin D và muối mật.
- Proteins
- Axit amin là các tiểu đơn vị của protein; 20 axit amin tạo nên protein của con người. Các liên kết peptit nối các axit amin với nhau (xem hình 2-8).
- Một protein bao gồm từ 50 đến hàng ngàn axit amin trong một chuỗi cụ thể (cấu trúc chính) được xếp thành một hình dạng cụ thể (cấu trúc bậc hai và bậc ba). Một số protein được tạo thành từ hai hoặc nhiều chuỗi axit amin (cấu trúc bậc bốn); một số protein chứa các nguyên tố vi lượng.
- Chức năng protein xem Bảng 25.
- Axit amin vượt quá nhu cầu tổng hợp protein được chuyển thành carbohydrates đơn giản hoặc thành chất béo, để sản xuất năng lượng.
- Enzyme là chất xúc tác, giúp tăng tốc độ phản ứng mà không cần thêm năng lượng. Lý thuyết vị trí hoạt động dựa trên hình dạng của enzyme và các phân tử chất nền: Chúng phải phù hợp (xem Hình 29). Các enzyme vẫn không thay đổi sau khi sản phẩm của phản ứng được giải phóng. Mỗi enzym là đặc hiệu cho một loại phản ứng. Chức năng của các enzym có thể bị gián đoạn bởi những thay đổi về pH hoặc nhiệt độ cơ thể, hoặc do sự hiện diện của chất độc, làm thay đổi hình dạng của các vị trí hoạt động của các enzym.
- Nucleic acids (xem Bảng 2–6 và Hình 2–10).
- Nucleotides là các tiểu đơn vị của axit nucleic. Một nucleotide bao gồm một đường pentose, một nhóm phosphate, và một base nitơ.
- DNA là một chuỗi kép của nucleotide, được cuộn thành một xoắn kép, với cặp base bổ sung: A T và G C. DNA tạo nên các nhiễm sắc thể của các tế bào và là mã di truyền để tổng hợp protein.
- RNA là một chuỗi nucleotide đơn lẻ, được tổng hợp từ DNA, với U thay cho hàm T. RNA trong tổng hợp protein; một số hình thức chức năng trong quá trình tổng hợp protein trong tế bào chất của tế bào.
- ATP là một nucleotide chuyên bẫy và truyền năng lượng (xem Hình 211). Năng lượng giải phóng từ thức ăn trong hô hấp tế bào được sử dụng để tổng hợp ATP từ ADP + P. Khi các tế bào cần năng lượng, ATP được chia nhỏ thành ADP + P và năng lượng được chuyển đến các quá trình tế bào.
CÂU HỎI ÔN TẬP
- Ghi rõ biểu tượng hóa học cho từng yếu tố sau: natri, kali, sắt, canxi, oxy, cacbon, hydro, đồng và clo. (p. 28)
- Giải thích, về các electron của chúng, làm thế nào một nguyên tử natri và một nguyên tử clo tạo thành một phân tử natri clorua. (p. 30)
3.
- Giải thích, về các electron của chúng, làm thế nào một nguyên tử cacbon và hai nguyên tử oxy tạo thành một phân tử carbon dioxide. (p. 34)
- Giải thích các chức năng của liên kết hydro
- Giải thích chức năng của liên kết disulfide.
- Tên các tiểu đơn vị (các phân tử nhỏ hơn) trong đó mỗi phân tử sau đây được tạo ra: DNA, glycogen, một chất béo thực sự và một protein (pp. 47, 39, 41, 43)
- Ghi rõ chính xác nơi trong cơ thể mỗi chất lỏng được tìm thấy: huyết tương, nước trong tế bào, bạch huyết, và chất lỏng mô. (p. 33)
- Giải thích lý do tại sao điều quan trọng đối với cơ thể là nước thay đổi nhiệt độ từ từ. (p. 33)
- Mô tả hai cách mà khả năng dung môi của nước là quan trọng đối với cơ thể (pp. 32–33)
- Tên phân tử hữu cơ với từng chức năng sau: (p. 40)
- Các mã di truyền trong nhiễm sắc thể
- Tự Kháng nguyên trong màng tế bào của chúng ta
- Các hình thức lưu trữ glucose trong gan.
- Các hình thức lưu trữ cho thực phẩm dư thừa trong mô mỡ.
- Các phân tử tiền chất cho các kích thích tố steroid.
- Các phần chưa tiêu hóa của thực phẩm thúc đẩy nhu động ruột.
- Đường là một phần của axit nucleic
- Viết phương trình tóm tắt hô hấp tế bào (p. 34)
- Nêu rõ vai trò hoặc chức năng của từng phần sau trong hô hấp tế bào: CO2, glucose, O2, nhiệt và ATP. (p. 35)
- Chỉ định một chức năng cụ thể của từng yếu tố sau trong cơ thể con người: Ca, Fe, Na, I, and Co. (p. 35)
- Giải thích, về nồng độ tương đối của ion H + và ion OH, mỗi chất sau: axit, bazơ và chất trung tính.. (pp. 36–37)
- Cho biết độ pH bình thường của máu (p. 36)
- Hoàn thành phương trình sau và nêu rõ mỗi sản phẩm ảnh hưởng như thế nào đến pH: (pp. 36–37) HCl + NaHCO3 → _______ + _______
- Giải thích nguyên lý hoạt động của enzyme hoạt động. (p. 44)
- Giải thích sự khác biệt giữa phản ứng tổng hợp và phản ứng phân hủy.. (pp. 44–46)
MỤC TIÊU NÂNG CAO
- Nước cam thường có độ pH khoảng 4. Làm thế nào để so sánh với độ pH của máu người? Tại sao chúng ta có thể uống nước cam mà không làm gián đoạn độ pH của máu?
- Estrela, 7 tuổi, có ngũ cốc nóng với sữa và đường cho bữa sáng và sau đó đi bộ đến trường. Giải thích mối quan hệ giữa ăn uống và đi bộ; hãy nhớ rằng Estrela đang thở.
- Cơ thể có thể lưu trữ một số chất dinh dưỡng nhất định. Đặt tên cho các biểu mẫu lưu trữ và nêu rõ một lợi thế và bất lợi.
- Nhiều viên thuốc vitamin cũng chứa các khoáng chất. Khoáng chất nào có thể được tìm thấy trong các chất bổ sung chế độ ăn uống như vậy? Những khoáng chất này có mục đích gì; đó là, chức năng của chúng là gì?
- Chì là một nguyên tố độc đối với con người; nó độc vì nó phản ứng dễ dàng với lưu huỳnh. Nhóm phân tử hữu cơ nào có nhiều khả năng bị tổn thương nhất bởi chì và tại sao?
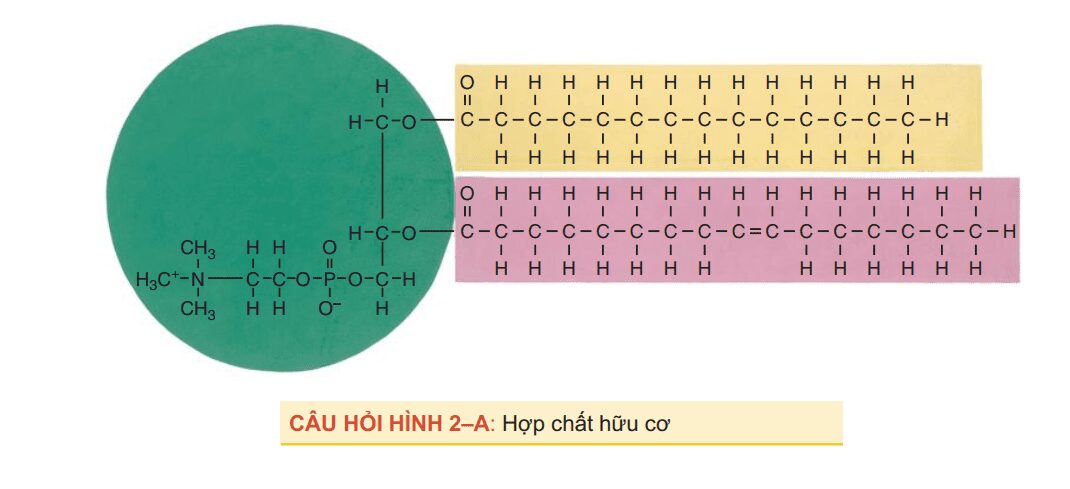
- Tìm hiểu về phân tử hữu cơ được mô tả trong Câu hỏi Hình 2 A. Bắt đầu bằng cách đặt tên cho danh mục chính (một trong bốn loại) và sau đó xem bạn có thể cụ thể như thế nào. Ngay cả khi bạn không chắc chắn, đưa ra lý do cho các phân tử có thể bạn có thể loại bỏ.
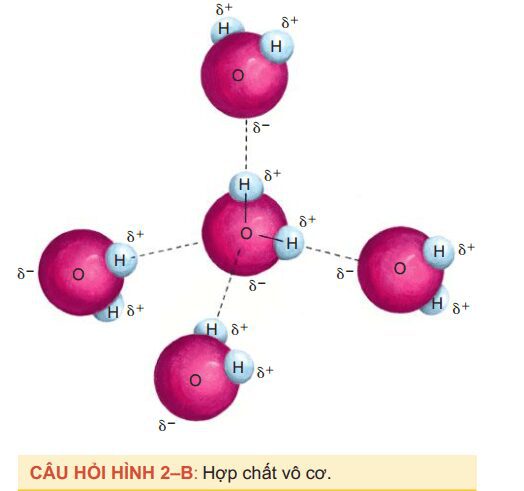
- Nhìn vào phân tử của hợp chất hữu cơ được mô tả trong câu hỏi hình 2–B; chúng đều giống nhau. Chúng là năm phân tử gì? Kiểu liên kết hóa học giữa chúng là gì? Kiểu liên kết hóa học (thể hiện bởi vết gạch đứt) giữ năm phân tử này lại với nhau là gì? (Chữ cái Hy Lạp viết thường delta [δ+ or δ–] cho biết phần mang điện tích dương hay phần mang điện tích âm.) Kiểu liên kết này tạo nên tính chất vật lí gì cho chất đó?
 Nguồn: Essentials of Anatomy and Physiology – Vietnamese Version.
Nguồn: Essentials of Anatomy and Physiology – Vietnamese Version.
 Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.
Y khoa Diễn đàn Y khoa, y tế sức khoẻ, kiến thức lâm sàng, chẩn đoán và điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.