Ngoài chức năng tiêu hóa, tụy còn bài tiết hai hormon quan trọng, insulin và glucagon, quyết định sự điều hòa quá trình chuyển hóa glucose, lipid, và protein. Mặc dù tụy tiết nhiều hormon khác, như amylin, somatostatin, và pancreatic polypeptide, chức năng của chúng chưa được biết rõ. Mục đích chính của chương này là bàn luận về vai trò sinh lý của insulin và glucagon và sinh lý bệnh của các bệnh lý, đặc biệt là đái tháo đường, do bất thường xảy ra ở quá trình bài tiết hoặc hoạt động của các hormon này.
Giải phẫu sinh lý của tụy
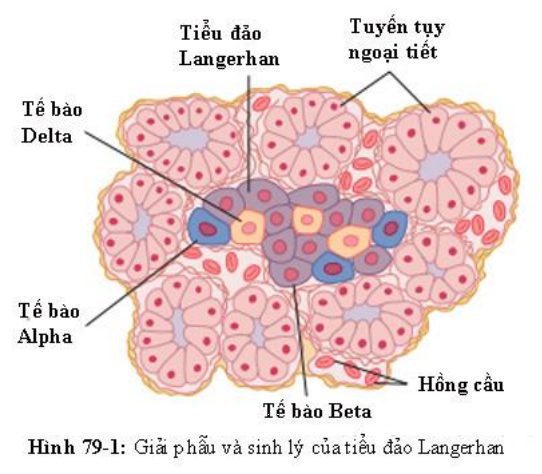
Tụy được cấu thành bởi hai loại mô chính, như Hình 79.1: (1) tuyến tụy ngoại tiết, tiết dịch tiêu hóa vào tá tràng và (2) tiểu đải Langerhans, bài tiết insulin và glucagon trực tiếp vào máu. Sự tiết dịch tiêu hóa của tụy được bàn luận ở chương 65.
Ở người, tụy có 1 đến 2 triệu tiểu đảo Langerhans. Mỗi tiểu đảo có đường kính khoảng 0.3 mm nằm xung quanh các mao mạch nhỏ. Các tế bào bài tiết hormon vào các mao mạch này. Tiểu đảo chứa 3 loại tế bào chính: tế bào anpha, tế bào beta, và tế bào delta khác nhau về hình thái và đặc điểm khi nhuộm.
Tế bào beta, chiếm khoảng 60% tổng số tế bào ở đảo tụy, nằm chủ yếu ở giữa mỗi tiểu đảo và tiết insulin, amylin, một hormon thường được bài tiết cùng insulin, mặc dù chức năng của nó chưa được biết rõ. Tế bào anpha, khoảng 25% tổng số tế bào, có vai trò tiết glucagon, và tế bào delta chiếm khoảng 10%, tiết somatostatin. Ngoài ra, có ít nhất một loại tế bào khác, tế bào PP, xuất hiện với số lượng nhỏ ở đảo tụy và bài tiết một hormon chưa rõ chức năng được gọi là pancreatic polypeptide.
Mối quan hệ gần gũi giữa những loại tế bào này ở đảo tụy cho phép liên hệ giữa các tế bào và trực tiếp điều khiển sự bài tiết các hormon bởi các hormon khác. Ví dụ như, insulin ức chế bài tiết glucagon, amylin ức chế tiết insulin, và somatostatin ức chế bài tiết cả insulin và glucagon.
INSULIN VÀ ẢNH HƯỞNG CỦA NÓ LÊN CHUYỂN HÓA
Insulin lần đầu tiên được phân lập ở tụy vào năm 1922 bởi Banting và Best, mở ra triển vọng cho bệnh nhân mắc đái tháo đường nghiêm trọng thay đổi từ suy kiệt nhanh chóng, tử vong tiến tới gần như một người bình thường. Trong lịch sử, insulin được biết đến rằng có liên hệ với “đường huyết”, và đúng như vậy, insulin có ảnh hưởng lớn đến quá trình chuyển hóa carbohydrate. Tuy nhiên, bất thường về chuyển hóa chất béo gây ra các bệnh như nhiễm toan (acidosis) và xơ vữa động mạch (arteriosclerosis) cũng là nguyên nhân quan trọng dẫn đến biểu hiện bệnh lý và tử vong ở bệnh nhân đái tháo đường. Thêm vào đó, ở bệnh nhân mắc đái tháo đường kéo dài, không được điều trị, giảm chức năng tổng hợp protein dẫn đến teo các mô và bất thường chức năng của nhiều tế bào. Vì vậy, Rõ ràng rằng insulin có tác động lên cả quá trình chuyển hóa chất béo và protein nhiều như tác động lên quá trình chuyển hóa carbohydrate.
INSULIN LÀ MỘT HORMON LIÊN QUAN ĐẾN SỰ DƯ THỪA NĂNG LƯỢNG
Ở những trang tiếp theo, chúng ta sẽ thảo luận và làm rõ ràng hơn sự liên quan của quá trình bài tiết insulin với sự dư thừa năng lượng. Nghĩa là, khi chế độ ăn của một người cung cấp quá nhiều năng lượng, đặc biệt là carbohydrate, quá trình bài tiết insulin sẽ tăng. Ngược lại, insulin đóng vai trò quan trọng trong dự trữ năng lượng. Trong trường hợp dư thừa carbohydrate, dẫn đến chúng được dự trữ dưới dạng glycogen, chủ yếu tại gan và cơ. Hơn nữa, tất cả carbohydrate dư thừa nếu không thể được dự trữ dưới dạng glycogen sẽ được chuyển thành chất béo dưới sự kích thích của insulin và được dự trữ ở mô mỡ. Trong trường hợp với protein, insulin trực tiếp tác động tăng cường sự hấp thu các amino acid bởi tế bào và chuyển các amino acid thành protein. Hơn nữa, nó ức chế thoái hóa protein sẵn có trong tế bào.
CẤU TRÚC HÓA HỌC VÀ SỰ TỔNG HỢP INSULIN
Insulin là một protein nhỏ. Insulin người là một phân tử có khối lượng 5808 kDa, gồm 2 chuỗi acid amin (xem Hình 79-2) được liên kết với nhau bởi những cầu nối disulfide. Khi 2 chuỗi amino acid này bị tách ra, phân tử insulin bị mất hoạt tính chức năng.
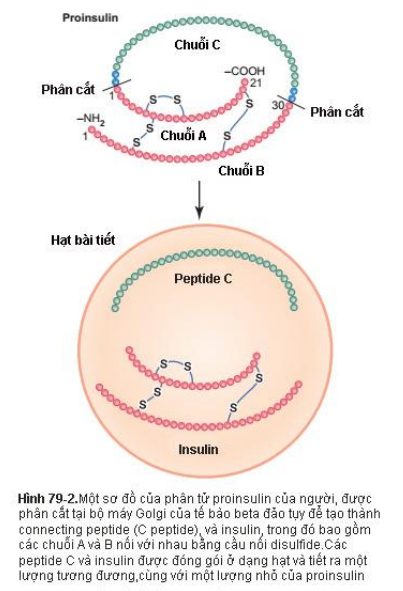
Insulin được tổng hợp ở tế bào beta bởi hệ thống tổng hợp protein thông thường của tế bào, như đã trình bày ở chương 3, bắt đầu bằng việc dịch mã insulin ARN bởi ribosom gắn trên lưới nội sinh chất hạt để hình thành preproinsulin. Phân tử preproinsulin ban đầu có khối lượng 11500 kDa, nhưng sau đó bị cắt ra tại lưới nội chất hạt để hình thành proinsulin có khối lượng 9000 kDa và gồm 3 chuỗi polypeptide A, B, C. Hầu hết proinsulin được cắt tiếp tục ở bộ máy Golgi để hinh thành insulin, gồm hai chuỗi A và B liên kết với nhau bởi các cầu nối disulfide, và chuỗi peptide C, được gọi là connecting peptide (peptide C). Insulin và peptide C được bao gói chung trong hạt tiết và được bài tiết một lượng cân bằng. Khoảng 5-10% sản phẩm tiết cuối cùng vẫn ở dạng proinsulin.
Proinsulin và peptide C gần như không có tác dụng của insulin. Tuy nhiên, peptide C gắn với một cấu trúc màng tế bào, rất có thể là receptor màng bắt cặp với protein G (G protein – coupled membrain receptor, GPCR), và gây ra kích hoạt ít nhất hai hệ thống enzyme, Na-K adenosine triphosphatase và endothelial NO synthase. Mặc dù cả hai hệ thống enzyme này có nhiều chức năng sinh lý nhưng tầm quan trọng của peptide C trong điều hòa những enzyme này vẫn chưa rõ ràng.
Mức độ peptide C có thể đo được bằng phản ứng miễn dịch phóng xạ (Radioimmunoassay: RIA) ở những bệnh nhân đái tháo đường được điều trị bằng insulin để phát hiện có bao nhiêu insulin tự nhiên vẫn được tổng hợp. Những bệnh nhân đái tháo đường type 1 không thể sản xuất insulin sẽ thường có mức độ peptide C giảm đáng kể.
Khi insulin được bài tiết vào máu, nó hầu như lưu thông ở dạng tự do (unbound form). Bởi vì nó có thời gian bán hủy trung bình chỉ khoảng 6 phút nên phần lớn chúng bị loại bỏ khỏi tuần hoàn trong 10-15 phút.
Ngoại trừ phần insulin kết hợp với receptor tại tế bào đích, insulin bị phân hủy bởi enzyme insulinase chủ yếu xảy ra ở gan, một lượng nhỏ hơn ở thận và cơ, và một lượng rất nhỏ ở những mô khác. Sự loại bỏ nhanh chóng insulin khỏi huyết tương là quan trọng vì nó làm nhanh chóng “tắt” những chức năng kiểm soát đã được “bật” bởi insulin.
KÍCH HOẠT RECEPTOR TẾ BÀO ĐÍCH BỞI INSULIN VÀ NHỮNG KẾT QUẢ MANG LẠI
Để bắt đầu nó tác động lên tế bào đích, đầu tiên insulin gắn và hoạt hóa receptor màng, là một protein có khối lượng khoảng 300,000 kDa (Hình 79-3). Nó hoạt hóa receptor gây ra những tác động tiếp sau.
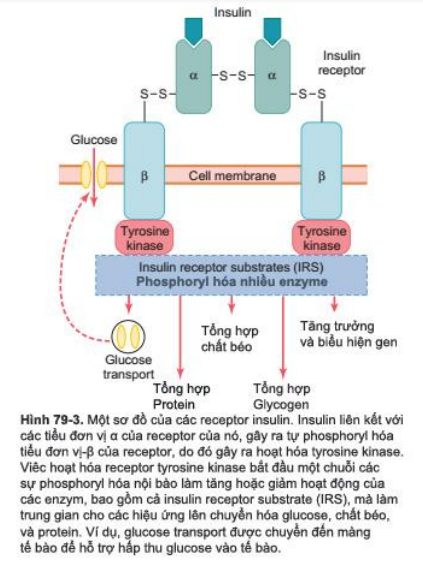
Receptor insulin gồm 4 tiểu đơn vị, chúng giữ nhau bằng những cầu nối disulfide: 2 tiểu đơn vị anpha nằm hoàn toàn phía ngoài màng tế bào và 2 tiểu đơn vị beta xuyên qua màng tế bào, nhô vào bên trong bào tương. Insulin gắn với tiểu đơn vị alpha ở phía ngoài tế bào, nhưng bởi có liên kết với tiểu đơn vị beta, các phần của tiểu đơn vị beta phía trong tế bào trở nên tự phosphoryl hóa. Vì vậy, receptor insulin là một ví dụ của enzyme liên kết receptor, đã được bàn luận ở chương 75. Quá trình tự phosphoryl hóa của tiểu đơn vị beta của receptor kích hoạt enzyme tyrosine kinase tại chỗ, nó sẽ gây ra sự phosphoryl hóa của nhiều enzyme nội bào khác, bao gồm 1 nhóm gọi là insulin-receptor subtrates (IRS). Những type khác nhau của IRS (VD: IRS-1, IRS-2, và IRS-3) biểu hiện ở những mô khác nhau. Thực tế, chúng có tác dụng hoạt hóa một số enzyme trong khi bất hoạt một số enzyme khác. Bằng cách này, insulin điều khiển bộ máy chuyển hóa nội bào để tạo ra những tác dụng muốn có trong chuyển hóa carbohydrat, chất béo và protein. Sau đây là những ảnh hưởng chính sau cùng của sự kích thích của insulin:
- Trong vài giây sau khi insulin gắn với receptor màng, màng tế bào của khoảng 80% tế bào của cơ thể tăng rõ ràng sự hấp thu glucose. Hoạt động này đặc biệt đúng ở tế bào cơ và tế bào mỡ, nhưng nó không đúng với hầu hết nơ-ron ở não. Glucose được tăng vận chuyển vào trong tế bào ngay lập tức bị phosphoryl hóa và trở thành nguyên liệu cho chức năng chuyển hóa carbohydrate thông thường. Sự tăng glucose transport được cho là kết quả của việc chuyển nhiều túi nội bào tới màng tế bào; các túi mang nhiều phân tử protein glucose transport, chúng gắn lên màng tế bào và tạo điều kiện hấp thu dễ dàng glucose vào tế bào. Khi insulin không còn tác dụng, những túi tách ra từ màng tế bào trong 3-5 phút và trở lại bên trong tế bào để sử dụng lại khi cần thiết.
- Màng tế bào trở nên tăng tính thấm với amino acid, K+ , PO43- , do tăng vận chuyển những đơn vị này vào trong tế bào.
- Tác dụng chậm hơn xuất hiện trong vòng 10-15 phút tiếp theo do thay đổi mức độ hoạt động của những enzyme chuyển hóa nội bào. Tác dụng này là kết quả chính từ sự thay đổi trạng thái phosphoryl hóa của các enzyme.
- Tác dụng kéo dài hơn tiếp tục xảy ra trong nhiều giờ, thậm chí vài ngày. Nó là kết quả từ thay đổi tốc độ dịch mã mARN tại ribosome để hình thành protein mới và vãn còn tác dụng chậm do thay đổi tốc độ phiên mã của AND trong nhân tế bào. Bằng cách này, insulin bù đắp bộ máy enzyme nội bào để đem lại một vài tác dụng chuyển hóa của nó
ẢNH HƯỞNG CỦA INSULIN LÊN CHUYỂN HÓA CARBOHYDRAT
Ngay sau khi chúng ta ăn một lượng lớn carbohydrat, glucose được hấp thu vào trong máu nhanh chóng gây ra sự bài tiết insulin, sẽ được bàn luận sau. Insulin nhanh chóng gây ra hấp thu, dự trữ và sử dụng glucose ở hầu hết tất cả các mô trong cơ thể, đặc biệt là mô cơ, mô mỡ và gan.
Insulin làm tăng quá trình hấp thu và chuyển hóa glucose ở cơ
Hầu hết thời gian trong ngày, mô cơ không phụ thuộc vào glucose nhưng phụ thuộc vào acid béo cho nhu cầu năng lượng. Lý do chính cho sự phụ thuộc vào acid béo là khi ở trạng thái nghỉ, màng tế bào cơ có tính thấm thấp với glucose, ngoại trừ khi sợi cơ bị kích thích bởi insulin. Giữa các bữa ăn, lượng insulin được bài tiết ra rất nhỏ để có thể làm tăng đáng kể lượng glucose vào tế bào cơ.
Tuy nhiên, dưới 2 điều kiện, tế bào cơ sử dụng 1 lượng lớn glucose. Thứ nhất là trong những bài tập trung bình và nặng. Sự sử dụng glucose không cần đến một lượng lớn insulin vì cơ co làm tăng sự di chuyển (translocation) của glucose transporter 4 (GLUT4) từ kho dự trữ bên trong tế bào tới màng tế bào, điều này làm tăng sự khuếch tán được thuận hóa (facilitates diffusion) của glucose vào trong tế bào.
Điều kiện thứ hai để tế bào cơ sử dụng 1 lượng lớn glucose là trong vài giờ sau bữa ăn. Lúc này nồng độ glucose trong máu tăng cao và tụy tiết ra một lượng lớn insulin. Việc tăng lượng insulin làm cho glucose nhanh chóng được vận chuyển vào tế bào cơ, điều này làm cho tế bào cơ sử dụng glucose ưu tiên hơn acid béo trong giai đoạn này, sẽ bàn luận ở phần sau.
Dự trữ glycogen ở cơ.
Nếu cơ không vận động sau bữa ăn và glucose được vận chuyển nhiều vào tế bào cơ, thay vì sử dụng để tạo năng lượng, hầu hết glucose được dự trữ dưới dạng glycogen ở cơ, vượt ngưỡng giới hạn 2-3%. Glycogen có thể được sử dụng ở cơ sau đó để tạo năng lượng. Glycogen rất hữu ích để cung cấp năng lượng trong vận động cực độ của cơ trong thời gian ngắn và thậm chí cung cấp năng lượng do giai đoạn bộc phát chuyển hóa yếm khí trong vài phút khi mà quá trình glycolytic bẻ gãy glycogen thành acid lactic khi thiếu oxy.
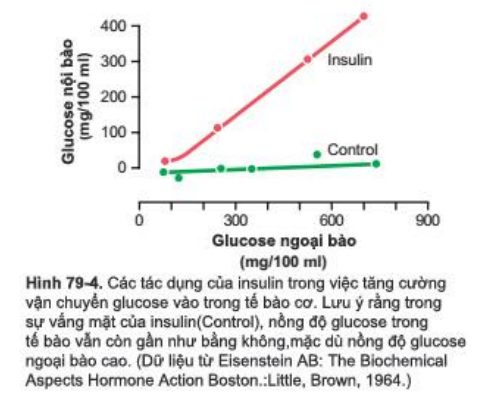
Định lượng tác dụng của insulin với vận chuyển thuận hóa glucose qua màng tế bào cơ. Định lượng tác dụng của insulin với vận chuyển thuận hóa glucose qua màng tế bào cơ được chứng minh bằng kết quả thí nghiệm trong Hình 79-4. Đường cong thấp nhất là ký hiệu cho nhóm chứng cho biết nồng độ glucose tự do đo được bên trong tế bào, chứng minh rằng nồng độ glucose nội bào vẫn gần như bằng không trong khi nồng độ glucose ngoại bào đã tăng cao tới 750mg/100ml. Ngược lại, đường cong biểu thị kết quả của “insulin” chứng minh nồng độ glucose nội bào tăng cao tới 400mg/100ml khi được thêm insulin. Do đó, Rõ ràng rằng insulin có thể làm tăng vận chuyển glucose vào tế bào cơ lúc nghỉ ít nhất là 15 lần.
Insulin tăng hấp thu, dự trữ và sử dụng glucose ở gan.
Một trong những tác dụng quan trong của insulin là làm tăng hấp thu glucose sau bữa ăn để tăng nhanh dự trữ glucose tại gan dưới dạng glycogen. Sau đó giữa các bữa ăn, khi thức ăn chưa được bổ sung, nồng độ glucose trong máu bắt đầu giảm, quá trình tiết insulin giảm nhanh và glycogen ở gan phân cắt trở lại thành glucose, rồi được bài tiết vào trong máu giữ cho nồng độ glucose không xuống quá thấp.
Cơ chế của insulin làm tăng hấp thu và dự trự glucose ở gan bao gồm nhiều bước xảy ra gần như đồng thời:
- Insulin bất hoạt phosphorylase ở gan, enzym chủ yếu cho quá trình chuyển glycogen thành glucose. Sự bất hoạt này ngăn chặn sự bẻ gãy glycogen được dự trữ trong tế bào gan.
- Insulin làm tăng hấp thu glucose từ máu vào gan bằng cách tăng hoạt tính của enzyme glucokinase, một trong những enzyme khởi đầu quá trình phosphoryl hóa glucose sau khi glucose được khuếch tán vào tế bào gan. Một khi bị phosphoryl hóa, glucose tạm thời bị giữ bên trong tế bào vì khi bị phosphoryl hóa glucose không thể khuếch tán qua màng tế bào.
- Insulin cũng làm tăng hoạt động của các enzyme làm tăng tổng hợp glycogen, bao gồm glycogen synthase, trùng hợp các đơn vị monosaccharide để hình thành phân tử glycogen.
Tác dụng thực tế của những hoạt động trên làm tăng lượng glycogen ở gan. Glycogen có thể tăng bằng khoảng 5-6% khối lượng gan, tương đương với 100g glycogen được dự trữ bên trong gan.
Glucose được giải phóng từ gan giữa các bữa ăn. Khi mức độ glucose máu bắt đầu giảm tới một mức thấp giữa các bữa ăn, nhiều sự kiện diễn ra làm gan giải phóng glucose trở lại tuần hoàn:
- Giảm glucose máu làm cho tụy giảm tiết insulin.
- Thiếu hụt insulin sau đó làm nghịch đảo lại tất cả các hiệu ứng làm tăng dự trữ glycogen trước đó được liệt kê, cơ bản ngăn chặn sự tổng hợp thêm glycogen trong gan và ngăn ngừa sự hấp thu glucose từ máu vào gan.
- Thiếu hụt insulin (kéo dài kết hợp với tăng glucagon, sẽ bàn luận sau) hoạt hóa enzyme phosphorylase, cắt glycogen thành glucose phosphate.
- Enzyme glucose phosphatase, bị ức chế bởi insulin, bây giờ trở nên hoạt động do dự thiếu hụt insulin làm cho gốc phosphate bị cắt khỏi glucose, cho phép glucose tự do khuếch tán trở lại máu.
Do đó, gan lấy glucose từ máu khi glucose tăng sau bữa ăn và đưa trở lại máu khi nồng độ glucose giảm giữa các bữa ăn. Thông thường, khoảng 60% glucose trong bữa ăn được dự trữ theo cách này tại gan và quay trở lại sau đó.
Insulin làm tăng chuyển glucose thừa thành acid béo và ức chế tân tạo glucose (gluconeogenesis) ở gan.
Khi lượng glucose vào tế bào gan nhiều hơn lượng có thể dự trữ dưới dạng glycogen hoặc có thể sử dụng cho chuyển hóa tại tế bào gan, insulin làm tăng chuyển toàn bộ lượng glucose thừa này thành acid béo. Acid béo sau đó được đóng gói dưới dạng triglyceride trong VLDL, vận chuyển dưới dạng này từ máu đến mô mỡ và hình thành mỡ.
Insulin cũng ức chế quá trình tân tạo đường chủ yếu bằng cách giảm số lượng và hoạt động của các enzyme cần thiết cho quá trình tân tạo đường. Tuy nhiên, một phần hiệu ứng này gây ra bởi việc giảm giải phóng amino acid từ cơ và những mô khác ngoài gan và các tiền chất có sẵn cần thiết cho quá trình tân tạo đường. Hiện tượng này tiếp tục được thảo luận liên quan đến tác dụng của insulin lên chuyển hóa protein.
Sự vắng mặt tác dụng của insulin trong hấp thu và sử dụng glucose ở não
Não hoàn toàn khác so với những mô khác trong cơ thể, insulin có rất ít tác dụng trong việc hấp thu và sử dụng glucose. Hầu hết tế bào não cho phép thấm glucose và có thể sử dụng glucose không cần đến trung gian insulin.
Tế bào não cũng hoàn toàn khác so vơi những tế bào khác trong cơ thể, nó thường chỉ sử dụng glucose để cung cấp năng lượng, có thể sử dụng những phân tử năng lượng khác như chất béo chỉ khi khó khăn. Do đó, điều quan trọng là mức đường trong máu luôn được duy trì trên một mức giới hạn, đó là một trong những chức năng quan trọng nhất của hệ thống kiểm soát đường huyết. Khi mức đường huyết giảm xuống quá thấp, khoảng 20-50mg/100ml, các triệu chứng sốc hạ đường huyết bắt đầu xuất hiện, đặc trưng bởi kích thích thần kinh tiến triển dẫn đến ngất xỉu, co giật và thậm chí là hôn mê.
Tác dụng của insulin lên chuyển hóa carbohydrat ở các tế bào khác.
Insulin tăng vận chuyển và sử dụng glucose ở hầu hết các tế bào trong cơ thể (trừ hầu hết tế bào não) theo cùng một cách tác động lên quá trình vận chuyển và sử dụng glucose ở tế bào cơ. Vận chuyển glucose vào tế bào mỡ chủ yếu cung cấp nguyên liệu cho tổng hợp phần glycerol của phân tử chất béo. Vì vậy, bằng cách này, insulin gián tiếp làm tăng tích tụ chất béo trong tế bào.
TÁC DỤNG CỦA INSULIN LÊN CHUYỂN HÓA CHẤT BÉO
Mặc dù không hoàn toàn rõ ràng như tác dụng nhanh của insulin lên chuyển hóa carbohydrat, tác dụng của insulin lên chuyển hóa chất béo là về lâu dài và quan trọng không kém. Đặc biệt ấn tượng là ảnh hưởng lâu dài của tình trạng thiếu insulin trong việc gây ra xơ vữa động mạch, thường dẫn đến các cơn đau tim, đột quỵ não, tai biến mạch máu khác. Đầu tiên, tuy nhiên, chúng ta hãy thảo luận về những tác dụng nhanh của insulin lên quá trình chuyển hóa chất béo.
Insulin làm tăng tổng hợp và dự trữ chất béo.
Insulin có nhiều tác dụng dẫn đến dự trữ chất béo tại mô mỡ. Đầu tiên, insulin tăng sử dụng glucose ở hầu hết các mô, điều này tự động làm giảm sử dụng chất béo, do đó, chức năng này như là dự trữ chất béo. Tuy nhiên, insulin cũng làm tăng tổng hợp acid béo, đặc biệt khi có quá nhiều carbohydrate được hấp thu hơn lượng cần thiết sử dụng để cung cấp năng lượng, cung cấp nguyên liệu cho tổng hợp chất béo. Hầu như tất cả quá trình tổng hợp này bắt đầu ở tế vào gan, và acid béo sau đó được vận chuyển từ gan tới dự trữ tại các tế bào mỡ nhờ các lipoprotein trong máu. Những yếu tố sau dẫn đến tăng tổng hợp acid béo tại gan:
- Insulin tăng vận chuyển glucose vào tế bào gan. Sau khi nồng độ glycogen trong gan tăng 5- 6%, quá trình tổng hợp glycogen bị ức chế. Tất cả glucose được vận chuyển thêm vào gan trở thành dạng mỡ. Glucose được cắt thành phân tử pyruvat trong quá trình đường phân, và sau đó pyruvat chuyển thành acetyl coenzyme A (acetyl-CoA), nguyên liệu để tổng hợp acid béo.
- Lượng ion citrate và isocitrate thừa được hình thành bở chu trình acid citric khi quá nhiều glucose được sử dụng để sinh năng lượng. Những ion này sau đó trực tiếp hoạt hóa enzyme acetyl-CoA carboxylase, enzyme cần thiết chuyển acetyl-CoA thành malonyl-CoA, giai đoạn đầu tiên của quá trình tổng hợp acid béo.
- Hầu hết acid béo được tổng hợp tại gan và được sử dụng để hình thành triglyceride, dạng dự trữ thông thường của chất béo. Chúng giải phóng từ tế bào gan vào máu dưới dạng lipoprotein. Insulin hoạt hóa lipoprotein lipase ở thành mao mạch của mô mỡ, cắt trigliceride trở lại thành acid béo, cần thiết cho sự hấp thu chúng vào tế bào mỡ, nơi chúng được chuyển lại thành trigliceride và được dự trữ.
Vai trò của insulin trong dự trữ chất béo ở tế bào mỡ.
- Insulin ức chế hoạt động của lipase nhạy cảm với hormon (hormone-sensitive lipase). Lipase là enzyme giúp thủy phân triglyceride đã dự trữ ở tế bào mỡ. Do đó, ức chế giải phóng acid béo từ mô mỡ vào tuần hoàn.
- Insulin tăng cường vận chuyển glucose qua màng tế bào vào tế bào mỡ theo cùng cách làm tăng vận chuyển glucose vào tế bào cơ. Một phần nhỏ glucose được sử dụng để tổng hợp một lượng nhỏ acid béo, nhưng quan trọng hơn, nó cũng được dùng để tạo thành một lượng lớn αglycerol phosphate. Phân tử này cung cấp glycerol để kết hợp với acid béo để hình thành trigliceride, dự trữ trong tế bào mỡ. Do đó, khi không có insulin, sự dự trữ một lượng lớn acid béo được vận chuyển đến từ gan trong lipoprotein hầu như bị chặn lại.
Thiếu hụt insulin làm tăng sử dụng chất béo tạo năng lượng. Tất cả những cách giáng hóa chất béo để cung cấp năng lượng được tăng cường rất nhiều trong điều kiện thiếu insulin. Kể cả bình thường, điều này cũng xảy ra giữa các bữa ăn khi lượng tiết insulin là rất nhỏ, nhưng nó trở nên mạnh mẽ hơn ở những người mắc đái tháo đường khi lượng tiết insulin gần như bằng không. Kết quả của hiệu ứng này được mô tả ở phần sau.
Thiếu hụt insulin gây ra thoái hóa mỡ dự trữ và giải phóng acid béo tự do.
Trong điều kiện thiếu insulin, tất cả hiệu ứng của insulin được ghi ở trên giúp dự trữ chất béo bị đảo ngược. Hiệu ứng quan trọng nhất là enzyme lipase nhạy cảm với hooc-môn ở tế bào mỡ trở nên hoạt động mạnh hơn. Điều này làm thủy phân triglyceride dự trữ, giải phóng một lượng lớn acid béo và glycerol vào tuần hoàn máu. Kết quả là, nồng độ acid béo tự do bắt đầu tăng. Những acid béo tự do này trở thành nguồn năng lượng chính được sử dụng ở tất cả các mô trong cơ thể ngoại trừ não.
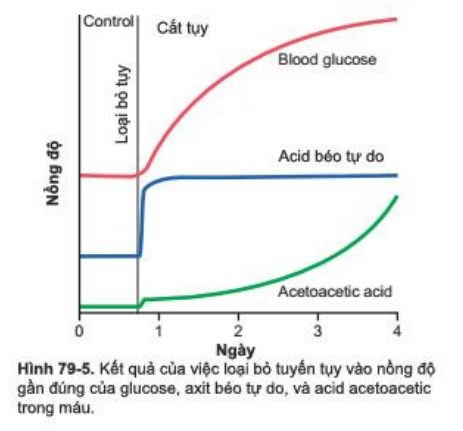
Hình 79-5 cho thấy tác động của sự thiếu hụt insulin lên nồng độ acid béo tự do trong huyết tương. Ghi nhận dường như ngay lập tức sau khi loại bỏ tụy, nồng độ acid béo tự do trong huyết tương bắt đầu tăng, thậm chí nhanh hơn tốc độ tăng nồng độ glucose.
Tình trạng thiếu hụt insulin làm tăng nồng độ cholesterol và phospholipid huyết tương. Sự dư thừa acid béo trong huyết tương liên quan đến sự thiếu hụt insulin làm tăng sự chuyển đổi tại gan của một số acid béo thành phospholipid và cholesterol, hai sản phẩm chính của chuyển hóa chất béo. Hai phân tử này, song song với sự dư thừa triglyceride được tổng hợp tại gan cùng thời điểm, rồi được đổ vào máu dưới dạng lipoprotein. Ngẫu nhiên lipoprotein huyết tương tăng khoảng 3 lần trong tình trạng thiếu hụt insulin, chiếm vài phần trăm trong tổng nồng độ lipid huyết tương chứ không phải như bình thường 0.6%. Nồng độ lipid cao đặc biệt là nồng độ cholesteron cao làm tăng sự tiến triển của bệnh xơ vữa động mạch ở bệnh nhân đái tháo đường.
Dư thừa sử dụng chất béo trong thiếu hụt insulin gây ra ketosis và acidosis.
Thiếu hụt insulin cũng gây ra dư thừa một lượng acid acetoacetic được hình thành trong tế bào gan. Sự dư thừa này là kết quả của hiệu ứng sau: Thiếu hụt insulin nhưng trước tình trang thừa acid béo ở tế bào gan, cơ chế vận chuyển cartinine giúp vận chuyển acid béo vào ty thể trở nên tăng cường hoạt động. Ở ty thể, quá trình beta oxi hóa acid béo diễn ra nhanh chóng, giải phóng ra một lượng lớn acetyl-CoA. Phần lớn của lượng acetyl-CoA dư thừa này sau đó được chuyển thành acid acetoacetic. Sau đó giải phóng vào máu. Hầu hết acid acetoacetic đi tới những tế bào ngoại vi, nơi chúng được chuyển trở lại thành acetyl-CoA và sử dụng cho năng lượng như bình thường.
Cùng lúc đó, sự thiếu hụt insulin cũng làm giảm sử dụng acid acetoacetic ở mô ngoại vi. Do đó, rất nhiều acid acetoacetic được giải phóng từ gan không thể được chuyển hóa hoàn toàn ở mô. Như trong Hình 79-5, nồng độ acid acetoacetic tăng trong vài ngày sau khi dừng tiết insulin, đôi khi, mức tăng nồng độ lên đến 10 mEq/l hoặc nhiều hơn, đó là trạng thái nhiễm toan nghiêm trọng của dịch cơ thể.
Như đã trình bày trong phần 69, một phần acid acetoacetic cũng chuyển thành acid βhydroxybutyric và aceton. 2 phân tử này, song song với acid acetoacetic, được gọi là thể ketone, và sự xuất hiện với một lượng lớn của chúng trong dịch cơ thể được gọi là ketosis. Chúng ta sẽ thấy lại chúng trong tiểu đường nặng, acid acetoacetic và acid β-hydroxybutyric có thể dẫn đến nhiễm toan nặng và hôn mê, có thể dẫn đến tử vong.
TÁC DỤNG CỦA INSULIN LÊN CHUYỂN HÓA PROTEIN VÀ TĂNG TRƯỞNG
Insulin làm tăng tổng hợp và sự trữ protein.
Protein, carbohydrate và chất béo được dự trữ ở mô trong vòng một vài giờ sau bữa ăn khi có một lượng chất dinh dưỡng dư thừa trong tuần hoàn; insulin cần thiết cho quá trình dự trữ này xảy ra. Cách mà insulin làm tăng tổng hợp protein chưa được hiểu rõ như với cơ chế trong dự trữ glucose và chất béo. Đây là một vài kết quả ghi nhận trong thực tế:
- Insulin kích thích vận chuyển nhiều amino acid vào trong tế bào. Trong các amino acid, vận chuyển mạnh nhất là valine, leucine, isoleucine, tyrosine và phenylalanine. Do đó insulin cùng với hormon tăng trưởng làm tăng hấp thu amino acid vào tế bào. Tuy nhiên, amino acid bị tác động độc lập không nhất thiết phải cùng acid amin khác.
- Insulin tăng dịch mã để tạo nên protein mới. Bằng một cách chưa rõ, insulin “bật” bộ máy ribosome. Khi thiếu hụt insulin, ribosome đơn giản là ngừng làm việc, gần như insulin hoạt động theo một cơ chế “bật-tắt”.
- Trong một khoảng thời gian dài, insulin cũng tăng tỷ lệ phiên mã các chuỗi AND chọn lọc trong nhân tế bào, do đó hình thành nên sự tăng lượng ARN và tổng hợp protein đặc biệt làm tăng nhiều enzyme cho dự trữ carbohydrate, chất béo và protein.
- Insulin ức chế dị hóa protein, do đó giảm tỷ lệ amino acid được giải phóng từ tế bào, đặc biệt là từ tế bào cơ. Có thể kết quả này từ khả năng của insulin làm giảm sự giáng hóa bình thường của tế bào bởi lysosome.
- Ở gan, insulin giảm tỷ lệ tân tạo glucose bằng cách giảm hoạt động của enzyme làm tăng quá trình tân tạo đường. Vì những nguồn nguyên liệu để tổng hợp glucose trong tân tạo đường là amino acid huyết tương, sự ức chế này tiết kiểm amino acid ở protein dự trữ trong cơ thể.
Tổng kết lại, insulin làm tăng hình thành protein và ngăn chặn giáng hóa protein.
Thiếu hụt insulin gây ra cạn kiệt protein và tăng acid amin huyết tương
Thực tế thì tất cả quá trình dự trữ protein dừng lại khi thiếu insulin. Dị hóa protein tăng, tổng hợp protein dừng lại và một lượng lớn acid amin giải phóng vào huyết tương. Nồng độ amino acid huyết tương tăng đáng kể, và hầu hết amino acid dư thừa được sử dụng trực tiếp để tạo năng lượng hoặc nguyên kiệu cho tân tạo đường. Giáng hóa amino acid cũng dẫn đến tăng urê bài xuất trong nước tiểu. Kết quả là protein bị hao hụt dần là một trong những ảnh hưởng quan trọng của đái tháo đường. Nó có thể dẫn đến sút cân nghiêm trọng và suy giảm chức năng nhiều cơ quan.
Insulin và hormon tăng trưởng tương tác hiệp đồng để làm tăng cường phát triển
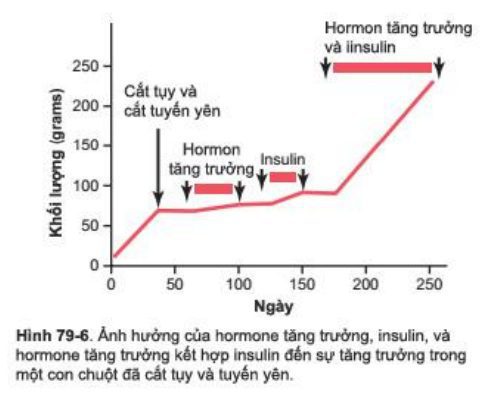
Do insulin cần thiết cho quá trình tổng hợp protein, nó cần thiết như một hooc-môn tăng trưởng cho sự phát triển của động vật. Như Hình 79-6, cắt bỏ tuyến tụy, cắt tuyến yên ở chuột nếu không được điều trị hiếm phát triển được dù chỉ một chút. Hơn nữa, Sự điều khiển bởi một trong 2 hormon này tại một thời điểm hầu như không tạo ra sự phát triển. Tuy nhiên sự kết hợp giữa hai hormon này đem lại sự phát triển ấn tượng, do đó xuất hiện sự tương tác chức năng của hai hormon này giúp thúc đẩy tăng trưởng, với từng vai trò chức năng đặc thù riêng biệt. Có lẽ cần thiết cả 2 hormon cho sự phát triển xuất phát từ thực tế rằng mỗi hormon tăng cường sự hấp thu vào tế bào một cách chọn lọc những amino acid khác nhau, và tất cả chúng đều cần thiết để tăng trưởng.
CƠ CHẾ BÀI TIẾT INSULIN
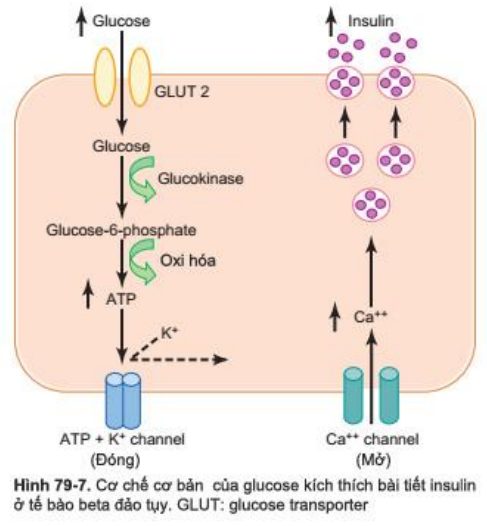
Hình 79-7 cho thấy cơ chế cấp độ tế bào của việc bài xuất insulin bởi tế bào beta đảo tụy đáp ứng với sự tăng nồng độ glucose trong máu, cơ chế chính điều khiển sự bài tiết insulin. Tế bào beta có một lượng lớn glucose transporter cho phép một lượng glucose nằm trong ngưỡng sinh lý vào trong tế bào. Bên trong tế bào, glucose được phosphoryl hóa thành glucose-6-phosphate bởi glucokinase. Sự phosphoryl hóa này có một ngưỡng cho chuyển hóa glucose ở tế bào beta, được cho là cơ chế chính của sự nhạy cảm với glucose gây tiết insulin.
Glucose-6-phosphat sau đó bị oxy hóa để hình thành ATP, gây ức chế kênh K+ nhạy cảm với ATP (ATP-sensitive potassium channels) của tế bào. Kênh kali đóng gây khử cực màng tế bào, làm mở kênh calci (voltage-gated calcium channels), kênh nhạy cảm với sự thay đổi điện thế của màng. Hiệu ứng này làm cho Calci vào tế bào kích thích những túi chứa insulin đi ra kết hợp với màng tế bào dẫn đến insulin được bài tiết theo hiện tượng xuất bào.
Những chất khác, như một vài amino acid, cũng có thể được chuyển hóa tại tế bào beta làm tăng mức ATP nội bào và kích thích tiết insulin. Một vài hooc-môn, như glucagon, glucose-dependent insulinotropic peptite (gastric inhibitory peptide – GIP), và acetylcholine, tăng calci nội bào thông qua con đường tín hiệu khác và tăng tác dụng của glucose, mặc dù vậy chúng không có nhiều tác dụng trong việc tiết insulin trong thiếu hụt glucose. Những hooc-môn khác, bao gồm somatostatin và norepinephrine (kích thích receptor anpha của hệ adrenergic), ức chế quá trình xuất bào của insulin.
Thuốc sunfonylurea kích thích bài tiết insulin bằng cách gắn vào kênh K+ nhạy cảm ATP và block hoạt động của chúng. Cơ chế này dẫn đến tác dụng khử cực màng rồi bài tiết insulin, làm cho thuốc này kích thích bài tiết insulin ở bệnh nhân đái tháo đường type 2, sờn bàn luận ở phần sau. Bảng 79-1 tổng kết những yếu tố có thể làm tăng hay giảm bài tiết insulin.

ĐIỀU HÒA BÀI TIẾT INSULIN
Có những lúc người ta tin rằng sự tiết insulin được điều khiển hầu như hoàn toàn bởi nồng độ glucose trong máu. Tuy nhiên, khi có hiểu biết hơn về chức năng chuyển hóa của insulin cho chuyển hóa protein và chất béo, nó đã trở nên rõ ràng rằng amino acid trong máu và những yếu tố khác cũng đóng vai trò quan trọng trong kiểm soát sự tiết insulin (xem Bảng 79-1).
Tăng glucose máu kích thích sự tiết insulin
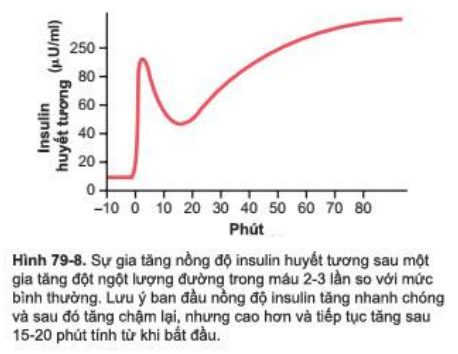
Bình thường nồng độ glucose lúc đói khoảng 80-90mg/100ml, mức độ tiết insulin thấp khoảng 25ng/phút/kg, mức độ mà chỉ có hoạt động sinh lý nhẹ. Nếu đường máu tăng đột ngột hai đến ba lần so với bình thường và giữ ở mức độ cao này sau đó, insulin sẽ tăng tiết rõ ràng ở hai giai đoạn, như cho thấy bởi sự thay đổi nồng đọ insulin huyết tương trong Hình 79-8
- Nồng độ insulin tăng trong huyết tương khoảng 10 lần trong 3 đến 5 phút sau khi glucose máu tăng đột ngột. Điều này là kết quả của sự giải phóng ngay lập tức insulin đã có sẵn trong tế bào beta của tiểu đảo Langerhan. Tuy nhiên, mức độ bài tiết lớn này không được duy trì, thay vào đó, nồng độ insulin giảm khoảng 1 nửa trong 5-10 phút.
- Bắt đầu sau khoảng 15 phút, insulin tăng tiết lần thứ hai và đạt đỉnh mới trong 2 đến 3 giờ, thời gian này mức độ tiết insulin thường lớn hơn giai đoạn đầu. Kết quả này là do sự giải phóng thêm insulin sẵn có và kích hoạt hệ thống enzyme tổng hợp và giải phóng insulin mới từ tế bào.
Feedback giữa nồng độ glucose máu và mức độ tiết insulin.
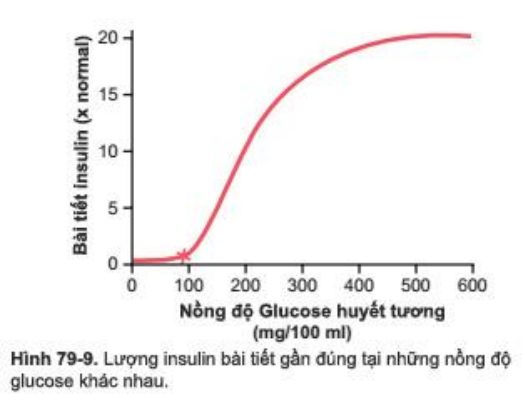
Nếu nồng độ glucose tăng trên 100mg/100ml, quá trình tiết insulin sẽ tăng nhanh, đạt đỉnh 10-25 lần mức cơ bản khi nồng độ glucose máu khoảng 400-600mg/100ml như trong Hình 79-9. Do đó tăng tiết insulin trong một kích thích bởi glucose là ấn tượng về cả tốc độ và mức độ tiết insulin có thể đạt được. Hơn nữa, sự dừng bài tiết insulin cũng không kém phầm nhanh chóng, xảy ra trong 3-5 phút sau khi nồng độ glucose máu giảm tới ngang mức đói
Đáp ứng này của sự bài tiết insulin với nồng độ glucose máu cao mang lại cơ chế feedback cực kỳ quan trọng cho điều hòa nồng độ glucose máu. Đó là, tăng glucose máu tăng tiết insulin, và insulin lần lượt tăng mức độ vận chuyển glucose vào gan, cơ và các thế bào khác, dẫn đến giảm nồng độ glucose máu trở về giá trị bình thường.
Những yếu tố khác kích thích tiết insulin Amino acid. Một vài amino acid có tác dụng tương tự glucose trong kích thích tiết insulin. Mạnh nhất là arginine và lysine. Hiệu ứng này khác với tác dụng của glucose: Amino acid kiểm soát khi không có sự tăng glucose máu và chỉ gây ra sự tăng tiết insulin rất nhỏ. Tuy nhiên, khi kiểm soát cùng lúc glucose máu cao, sự bài tiết insulin có thể tăng lên gấp đôi khi xuất hiện dư thừa amino acid. Do đó amino acid có vai trò tăng cường kích thích tiết insulin của glucose.
Kích thích tiết insulin bởi amino acid là quan trọng bởi vì insulin lần lượt tăng cường vận chuyển amino acid tới tế bào, cũng như sự hình thành protein trong tế bào. Do đó insulin quan trọng cho sử dụng hợp lý amino acid dư thừa cũng giống như nó quan trọng trong sử dụng carbohydrate
Gastrointestinal Hormone. Hỗn hợp nhiều hooc-môn dạ dày ruột quan trọng – gastrin, secretin, cholecystokinin, glucagonlike peptide-1 (GLP-1) và glucos-dependent insulinotropic peptide (GIP)- có thể gây ra tăng tiết insulin mức độ trung bình. Hai trong số các hormon trên, GLP-1 và GIP, biểu hiện mạnh nhất và thường được gọi là incretin bởi vì chúng tăng mức độ giải phóng insulin từ tế bào beta đảo tụy đáp ứng với sự tăng glucose huyết tương. Chúng cũng ức chế tiết glucagon từ tế bào anpha của tiểu đảo Langerhan.
Những hormon này được giải phóng ở hệ thống dạ dày ruột sau ăn. Chúng sau đó gây ra “tác dụng trước” tăng insulin trong máu để chuẩn bị cho sự hấp thu glucose và amino acid từ thức ăn. Những hormon này thường tác động theo cùng 1 cách như amino acid làm tăng độ nhạy cảm của sự bài tiết insulin với glucose đáp ứng với sự tăng glucose máu, hầu như gấp đôi lượng insulin được bài tiết trong khi mức độ glucose máu tăng. Như sẽ bàn luận sau ở chương này, nhiều thuốc tậm chí được phát triển tương tự hoặc làm tăng tác dụng của incretin cho điều trị đái tháo đường.
Những hormon khác và hệ thần kinh tự chủ.
Những hormon khác hoặc trực tiếp làm tăng tiết insulin hoặc tăng độ nhạy cảm với glucose với tiết insulin bao gồm glucagon, hormon tăng trưởng, cortisol và một phần progesterone và estrogen. Tầm quan trọng của các tác động kích thích của những hormone này là kéo dài sự bài tiết của bất kỳ một trong số chúng với số lượng lớn đôi khi có thể dẫn đến cạn kiệt các tế bào beta của đảo Langerhans và do đó làm tăng nguy cơ cho sự phát triển của bệnh tiểu đường. Thật vậy, bệnh tiểu đường thường xảy ra trong người nhận được liều cao và được duy trì của một số các hormone. Tiểu đường là đặc biệt phổ biến trong người giàu hoặc ở những người mắc bệnh to đầu chi (acromgalic), người có khối u tiết ra hormone tăng trưởng, cũng như ở những người có tuyến thượng thận tiết ra glucocorticoid dư thừa.
Các đảo tụy được đa dạng về phân bố các dây thần kinh giao cảm và phó giao cảm. Sự kích thích của các dây thần kinh phó giao cảm đến tuyến tụy có thể làm tăng tiết insulin trong điều kiện tăng đường huyết, trong khi sự kích thích thần kinh giao cảm có thể làm tăng tiết glucagon và giảm tiết insulin trong hạ đường huyết. Nồng độ glucose được cho là bị phát hiện bởi các tế bào thần kinh chuyên biệt của vùng dưới đồi và thân não, cũng như bởi các tế bào đường cảm ứng tại các vùng ngoại vi như gan.
VAI TRÒ CỦA INSULIN (VÀ NHỮNG HORMON KHÁC) TRONG “SỰ CHUYỂN ĐỔI” (“SWITCHING”) GIỮA CHUYỂN HÓA CARBOHYDRATE VÀ CHUYỂN HÓA LIPID.
Từ thảo luận trước đó, người ta có thể biết rõ rằng insulin thúc đẩy sử dụng carbohydrate cho năng lượng và làm giảm việc sử dụng các chất béo. Ngược lại, thiếu insulin gây ra việc sử dụng chất béo chủ yếu là để loại trừ việc sử dụng glucose, ngoại trừ mô não. Hơn nữa, các tín hiệu điều khiển cơ chế chuyển đổi này là chủ yếu là nồng độ glucose máu. Khi nồng độ glucose thấp, quá trình tiết insulin bị ức chế và chất béo được sử dụng gần như duy nhất cho năng lượng ở khắp mọi nơi ngoại trừ trong não. Khi nồng độ glucose máu cao, insulin được kích thích bài tiết và carbohydrate được sử dụng thay thế chất béo. Glucose dư thừa trong máu được dự trữ dưới dạng glycogen và chất béo ở gan, glycogen ở cơ. Vì vậy một trong những chức năng quan trọng của insulin trong cơ thể là kiểm soát cái gì trong hai loại thức ăn sẽ được dùng cho năng lượng tùy từng thời điểm.
Ít nhất bốn hormone đã biết khác cũng đóng vai trò quan trọng trong cơ chế chuyển đổi này: hormon tăng trưởng từ tuyến yên, cortisol từ vỏ thượng thận, epinephrine từ tủy thượng thận, và glucagon từ các tế bào alpha của tiểu đảo Langerhans ở tụy. Glucagon được thảo luận trong phần tiếp theo của chương này. Cả hai hormone tăng trưởng và cortisol được tiết ra để đáp ứng với tình trạng hạ đường huyết, và cả hai ức chế việc sử dụng glucose của tế bào đồng thời thúc đẩy việc sử dụng chất béo. Tuy nhiên, ảnh hưởng của cả hai hormon phát triển chậm, thường đòi hỏi nhiều giờ để biểu hiện tối đa.
Epinephrine đặc biệt quan trọng trong việc gia tăng nồng độ glucose huyết tương trong thời kỳ căng thẳng khi các hệ thống thần kinh giao cảm được kích thích. Tuy nhiên, epinephrine tác động khác với các hormone khác ở chỗ nó làm tăng nồng độ acid béo huyết tương cùng lúc. Những lý do cho những hiệu ứng này như sau: (1) epinephrine có hiệu ứng mạnh gây tân tạo glucose trong gan, do đó giải phóng lượng lớn glucose vào máu trong vòng vài phút, và (2) nó cũng có tác dụng thoái hóa trực tiếp trên tế bào mỡ vì nó kích hoạt lipase nhạy cảm với hormone ở các mô mỡ, do đó nâng cao đáng kể nồng độ của các axit béo trong máu. Về mặt định lượng, việc tăng cường các axit béo là lớn hơn nhiều so với việc tăng cường lượng đường trong máu. Do đó, epinephrine đặc biệt là tăng cường việc sử dụng các chất béo trong trạng thái căng thẳng như tập thể dục, sốc tuần hoàn, và lo lắng.
GLUCAGON VÀ CHỨNG NĂNG CỦA NÓ
Glucagon, một hormone được tiết ra bởi các tế bào alpha của tiểu đảo Langerhan khi nồng độ đường huyết giảm xuống, có một số chức năng đối nghịch với những chức năng của insulin. Điều quan trọng nhất của các chức năng này là làm tăng nồng độ glucose trong máu, một hiệu ứng mà là ngược lại với insulin.
Giống như insulin, glucagon là một polypeptide. Nó có trọng lượng phân tử 3485 kDa và bao gồm một chuỗi 29 axit amin. Sau khi tiêm glucagon tinh chế vào một con vật, một tác dụng tăng đường huyết xảy ra. Chỉ 1µg/kg glucagon có thể nâng cao nồng độ đường trong máu khoảng 20mg/100ml máu (tăng 25%) trong khoảng 20 phút. Vì lý do này, glucagon cũng được gọi là hormone tăng đường huyết.
TÁC DỤNG LÊN CHUYỂN HÓA GLUCOSE
Tác dụng lớn của glucagon lên chuyển hóa đường gồm (1) thoái hóa glycogen ở gan (glycogenolysis) và (2) tăng tân tạo đường (gluconeogenenesis) tại gan. Cả hai tác dụng này làm tăng đáng kể glucose đến những cơ quan khác trong cơ thể.
Glucagon gây ra thoái hóa glycogen và tăng nồng độ glucose trong máu.
Các tác dụng ấn tượng nhất của glucagon là khả năng gây thoái hóa glycogen trong gan, do đó làm tăng nồng độ glucose máu trong vòng vài phút. Nó thực hiện chức năng này thông qua các giai đoạn phức tạp sau:
- Glucagon hoạt hóa adenylyl cyclase ở màng tế bào gan.
- Dẫn đến hình thành cAMP.
- Dẫn đến hoạt hóa protein kinase regulator protein.
- Dẫn đến hoạt hóa protein kinase.
- Dẫn đến hoạt hóa phosphorylase b kinase.
- Dẫn đến chuyển phosphorylase b thành phosphorylase a.
- Làm tăng giáng hóa glycogen thành glucose-1-phosphate.
- Sau đó glucose-1-phosphate bị dephosphoryl tạo thành glucose và giải phóng vào tuần hoàn.
Chuỗi sự kiện này là cực quan trọng vì nhiều lý do. Đầu tiên, nó là một trong những nghiên cứu kỹ lưỡng nhất của tất cả các chức năng truyền tin thứ hai của chu kỳ monophosphate adenosine. Thứ hai, nó cho thấy một hệ thống liên tục, trong đó mỗi sản phẩm được sản xuất với số lượng lớn hơn các sản phẩm trước đó. Do đó, nó đại diện cho một cơ chế khuếch đại mạnh. Đây là loại cơ chế khuếch đại được sử dụng rộng rãi trên khắp cơ thể để kiểm soát, hệ thống trao đổi chất của tế bào, thường gây ra nhiều như một khuếch đại hàng triệu lần trong phản ứng. Cơ chế này giải thích làm cách nào mà chỉ có một vài microgram glucagon có thể làm nồng độ đường trong máu tăng gấp đôi hoặc thậm chí tăng nữa hơn trong vòng vài phút.
Truyền glucagon cho khoảng 4 giờ có thể làm gan thoái hóa glycogen mạnh và tất cả các kho dự trữ glycogen của gan trở nên cạn kiệt.
Glucagon làm tăng tân tạo glucose
Ngay cả sau khi tất cả các glycogen trong gan đã bị cạn kiệt dưới ảnh hưởng của glucagon, tiếp tục truyền của hormone này vẫn gây ra tiếp tục tăng đường huyết. tăng đường huyết này là kết quả tác động của glucagon để tăng tỷ lệ hấp thu axit amin của các tế bào gan và sau đó chuyển đổi của rất nhiều các axit amin thành glucose bởi quá trình tân tạo glucose. Hiệu ứng này đạt được bằng cách kích hoạt nhiều các enzym được yêu cầu để vận chuyển axit amin và tân tạo glucose, đặc biệt là kích hoạt của hệ thống enzym chuyển đổi pyruvate để phosphoenolpyruvate, một bước hạn chế mức tân tạo glucose.
Tác dụng khác của glucagon
Hầu hết các tác dụng khác của glucagon chỉ xảy ra khi nồng độ của nó tăng lên trên mức tối đa thường được tìm thấy trong máu. Có lẽ ảnh hưởng quan trọng nhất là glucagon kích hoạt lipase của tế bào mỡ, làm tăng lượng axit béo có sẵn cho các hệ thống năng lượng của cơ thể. Glucagon cũng ức chế sự lưu trữ của triglycerides trong gan, ngăn ngừa gan từ loại bỏ các axit béo trong máu; điều này cũng giúp làm cho khoản bổ sung các axit béo có sẵn cho các mô khác của cơ thể. Glucagon ở nồng độ cao cũng có (1) tăng cường sức mạnh của tim; (2) làm tăng lưu lượng máu trong một số mô, đặc biệt là thận; (3) tăng cường tiết mật; và (4) ức chế tiết acid dạ dày. Những ảnh hưởng của glucagon có lẽ ít quan trọng trong các chức năng bình thường của cơ thể khi so với ảnh hưởng của nó trên glucose.
ĐIỀU HÒA BÀI TIẾT GLUCAGON
Tăng glucose máu ức chế tiết glucagon
Nồng độ glucose máu mạnh hơn hẳn các yếu tố khác có vai trò kiểm soát bài tiết glucagon. Lưu ý đặc biệt, tuy nhiên, ảnh hưởng của nồng độ glucose trong máu trên tiết glucagon là chính xác theo hướng ngược lại từ tác động của glucose trong tiết insulin.
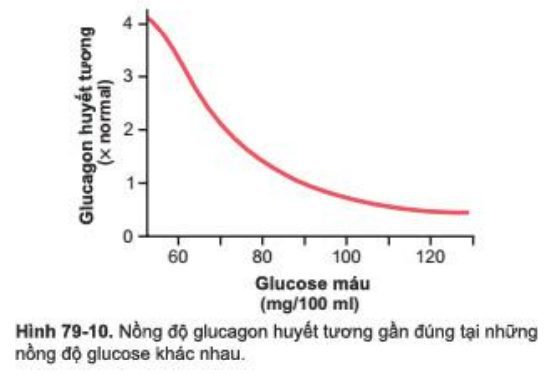
Điều này được thể hiện trong Hình 79-10, trong đó cho thấy rằng việc giảm nồng độ glucose máu từ mức bình thường khi đói của nó khoảng 90mg/100ml máu xuống mức hạ đường huyết có thể làm nồng độ glucagon trong huyết tương tăng lên vài lần. Ngược lại, tăng glucose máu đến mức độ tăng đường huyết, glucagon huyết tương giảm. Như vậy, trong hạ đường huyết, glucagon được tiết ra với số lượng lớn; sau đó nó làm tăng đáng kể sản lượng glucose từ gan và do đó phục vụ các chức năng quan trọng trong hạ đường huyết.
Tăng amino acid trong máu kích thích tiết glucagon
Nồng độ amino acid cao, như xảy ra sau bữa ăn giàu protein (đặc biệt là alanine và arginine), kích thích tiết glucagon. Tác dụng này giống với tác dụng của amino acid trong kích thích tiết insulin.
Như vậy, trong trường hợp này, glucagon và insulin phản ứng không phải là đối lập. Tầm quan trọng của kích thích axit amin tiết glucagon là glucagon sau đó thúc đẩy chuyển đổi nhanh chóng của các axit amin thành glucose, do đó thậm chí làm tăng glucose có trong các mô.
Tập thể dục kích thích tiết glucagon.
Trong thời gian tập thể dục đầy đủ, nồng độ máu của glucagon thường tăng gấp bốn lần cho gấp năm lần. Nguyên nhân của sự gia tăng này không được hiểu rõ bởi vì nồng độ glucose máu không nhất thiết phải giảm. Một tác dụng có lợi của glucagon là nó ngăn ngừa giảm đường huyết. Một trong những yếu tố có thể làm tăng tiết glucagon khi tập thể dục là tăng lưu thông axit amin. Các yếu tố khác, chẳng hạn như kích thích β-adrenergic của tiểu đảo Langerhans, cũng có thể đóng một vai trò trong quá trình này.
Somatostatin ức chế bài tiết glucagon và insulin.
Các tế bào delta của các tiểu đảo Langerhans tiết ra somatostatin, một polypeptide gồm 14 amino acid mà có thời gian bán hủy rất ngắn chỉ 3 phút trong máu. Hầu như tất cả các yếu tố liên quan đến việc tiêu hóa thức ăn kích thích tiết somatostatin. Những yếu tố này bao gồm: (1) glucose máu tăng, (2) các axit amin tăng, (3) các acid béo tăng, (4) tăng nồng độ của một số hormone tiêu hóa giải phóng từ đường tiêu hóa trên để đáp ứng với lượng thức ăn.
Lần lượt, Somatostatin có nhiều tác dụng ức chế như:
- Somatostatin hoạt động tại tại chỗ trong các tiểu đảo Langerhans của mình để ức chế bài tiết insulin và glucagon.
- Somatostatin giảm nhu động của dạ dày, tá tràng, và túi mật.
- Somatostatin giảm cả sự tiết và hấp thu ở đường tiêu hóa.
Kết hợp tất cả các thông tin, có ý kiến cho rằng vai trò chính của somatostatin là mở rộng khoảng thời gian mà các chất dinh dưỡng trong thức ăn được hấp thu vào máu. Đồng thời, tác dụng của somatostatin trong làm yếu đi sự tiết insulin và glucagon, giảm sử dụng các chất dinh dưỡng được hấp thụ bởi các mô, do đó ngăn ngừa sự cạn kệt nhanh chóng của thức ăn và do đó làm cho nó có sẵn trong một thời gian dài hơn. Cũng cần phải nhắc lại rằng somatostatin là chất hóa học tương tự như hormon ức chế hormone tăng trưởng, được tiết ra ở vùng dưới đồi và ức chế bài tiết hormone tăng trưởng của tuyến yên.
TỔNG KẾT SỰ ĐIỀU HÒA GLUCOSE MÁU
Ở người bình thường, nồng độ glucose máu được kiểm soát rất kỹ, thường khoảng 80- 90mg/100ml khi đói vào mỗi buổi sáng trước khi ăn. Nồng độ này tăng lên đến 120-140mg/100 ml trong giờ đầu tiên hoặc sau bữa ăn, nhưng các hệ thống thông tin phản hồi nhanh chóng đưa glucose máu quay trở lại mức độ kiểm soát, nồng độ glucose trở lại với mức độ kiểm soát, thường là trong vòng 2 giờ sau khi hấp thu carbohydrates . Ngược lại, trong tình trạng đói, chức năng tân tạo glucose tại gan cung cấp lượng đường cần thiết để duy trì nồng độ glucose trong máu lúc đói.
Các cơ chế để đạt được mức độ cao điều khiển này đã được trình bày trong chương này và có thể được tóm tắt như sau:
- Các chức năng gan như một hệ thống đệm glucose máu quan trọng. Đó là, khi lượng đường trong máu tăng lên đến một nồng độ cao sau bữa ăn và insulin tiết ra cũng tăng lên, hai phần ba lượng đường hấp thu từ ruột là gần như ngay lập tức được lưu trữ dưới dạng glycogen trong gan. Sau đó, trong suốt thời gian tiếp theo, khi nồng độ glucose trong máu và bài tiết insulin giảm, gan giải phóng glucose trở lại vào máu. Bằng cách này, gan giảm sự biến động nồng độ glucose trong máu bằng khoảng một phần ba mức độ biến động nếu không có chúng. Trong thực tế, ở những bệnh nhân có bệnh gan nặng, họ gần như không thể duy trì một phạm vi hẹp của nồng độ glucose trong máu.
- Cả hai chức năng của insulin và glucagon là hệ thống feedback kiểm soát quan trọng để duy trì nồng độ đường huyết bình thường. Khi nồng độ glucose tăng quá cao, tăng tiết insulin làm cho nồng độ glucose trong máu giảm về mức bình thường. Ngược lại, giảm lượng glucose trong máu kích thích bài tiết glucagon; chức năng của glucagon sau đó theo hướng ngược lại để tăng glucose về bình thường. Theo hầu hết các điều kiện bình thường, cơ chế feedback của insulin là quan trọng hơn so với các cơ chế của glucagon, nhưng trong trường hợp của nạn đói hoặc sử dụng quá nhiều glucose trong khi tập thể dục và tình huống căng thẳng khác, cơ chế glucagon cũng trở nên có giá trị.
- Trong hạ đường huyết nặng, ảnh hưởng trực tiếp của lượng đường trong máu thấp lên vùng dưới đồi cũng kích thích hệ thần kinh giao cảm. Epinephrine tiết ra bởi tuyến thượng thận làm tăng thêm phóng glucose từ gan, mà còn giúp bảo vệ chống hạ đường huyết nặng.
- Cuối cùng, trong khoảng vài giờ và vài ngày, cả hormon tăng trưởng và cortisol được tiết ra để đáp ứng với hạ đường huyết kéo dài. Cả hai đều làm giảm tỷ lệ sử dụng glucose của hầu hết các tế bào của cơ thể, chuyển đổi thay vì sử dụng một lượng lớn chất béo. Quá trình này cũng giúp trả lại nồng độ glucose trong máu đối với bình thường.
Tầm quan trọng của điều hòa đường huyết.
Người ta có thể hỏi: “Tại sao duy trì nồng độ đường trong máu liên tục rất quan trọng, đặc biệt là bởi vì hầu hết các mô có thể chuyển sang sử dụng các chất béo và protein thành năng lượng trong sự thiếu hụt của glucose?” Câu trả lời là glucose là chất duy nhất thông thường có thể được sử dụng bởi não, võng mạc và biểu mô mầm của tuyến sinh dục cần đủ số lượng để cung cấp cho chúng một cách tối ưu với năng lượng cần thiết của chúng. Do đó, điều quan trọng là duy trì nồng độ đường huyết ở mức đủ để cung cấp dinh dưỡng cần thiết này.
Hầu hết glucose hình thành bởi quá trình tân tạo đường trong thời gian giữa các bữa ăn được sử dụng cho quá trình chuyển hóa của não. Thật vậy, điều quan trọng là tuyến tụy không tiết insulin trong thời gian này; nếu không, các nguồn cung cấp rất ít glucose có sẵn tất cả sẽ đi vào các cơ bắp và các mô ngoại vi khác, để lại não bộ mà không còn một nguồn dinh dưỡng nào. Nó cũng quan trọng là nồng độ glucose trong máu không được tăng quá cao vì nhiều lý do:
- Glucose có thể gây một số lượng lớn của áp suất thẩm thấu trong dịch ngoại bào, và sự gia tăng nồng độ glucose đến các giá trị quá mức có thể gây mất nước nội bào đáng kể.
- Mức độ quá cao của nồng độ glucose trong máu gây ra mất của glucose qua nước tiểu.
- Mất glucose trong nước tiểu cũng đa niệu thẩm thấu, có thể làm suy yếu cơ thể do mất nước và điện giải.
- Tăng dài hạn glucose trong máu có thể gây thiệt hại cho nhiều mô, đặc biệt là các mạch máu. chấn thương mạch máu liên quan đến bệnh tiểu đường, không kiểm soát được bệnh đái tháo dẫn đến tăng nguy cơ đau tim, đột quỵ, bệnh thận giai đoạn cuối, và mù lòa.
ĐÁI THÁO ĐƯỜNG
Đái tháo đường là một hội chứng của sự suy yếu chuyển hóa carbohydrate, chất béo, và chuyển hóa protein gây ra bởi hoặc là thiếu hụt insulin hoặc giảm độ nhạy cảm của mô với insulin. Có hai loại chính của bệnh đái tháo đường:
- Bệnh tiểu đường type 1, còn được gọi là đái tháo đường phụ thuộc insulin, được gây ra bởi thiếu hụt sự bài tiết insulin.
- Bệnh tiểu đường type 2, còn được gọi là đái tháo đường không phụ thuộc insulin, ban đầu do giảm sự nhạy cảm của mô đích với tác dụng chuyển hóa của insulin. giảm sự nhạy cảm này với insulin thường được gọi là kháng insulin.
Trong cả hai loại bệnh tiểu đường, sự chuyển hóa của tất cả các thực phẩm chính là thay đổi. Các hiệu ứng cơ bản của tình trạng thiếu insulin hoặc kháng insulin đến quá trình chuyển hóa glucose là ngăn chặn sự hấp thu và sử dụng hiệu quả glucose của hầu hết các tế bào của cơ thể, ngoại trừ những tế bào trong não. Kết quả là, lượng đường trong máu tăng lên, việc sử dụng glucose của tế bào ngày càng thấp hơn, và tăng sử dụng các chất béo và protein.
ĐÁI THÁO ĐƯỜNG TYPE 1 – THIẾU HỤT SẢN XUẤT INSULIN BỞI TẾ BÀO BETA ĐẢO TỤY
Tổn thương tế bào beta đảo tụy hoặc các bệnh làm suy yếu sản xuất insulin có thể dẫn đến bệnh tiểu đường type 1. Nhiễm virus hoặc các rối loạn tự miễn có thể tham gia vào việc phá hủy tế bào beta ở nhiều bệnh nhân bị bệnh tiểu đường type 1, mặc dù di truyền cũng đóng một vai trò quan trọng trong việc xác định tính nhạy cảm của tế bào beta để phá hủy bởi chấn thương. Trong một số trường hợp, người có thể có xu hướng di truyền sự thoái hóa tế bào beta thậm chí không có nhiễm virus hay các rối loạn tự miễn.
Sự khởi đầu thông thường của bệnh tiểu đường type 1 xảy ra vào khoảng 14 tuổi tại Hoa Kỳ, và vì lý do này, nó thường được gọi là bệnh tiểu đường vị thành niên. Tuy nhiên, bệnh tiểu đường type 1 có thể xảy ra ở bất cứ tuổi nào, kể cả tuổi trưởng thành, rối loạn dẫn đến sự phá hủy của các tế bào beta đảo tụy. Bệnh tiểu đường type 1 có thể phát triển đột ngột, trong khoảng thời gian một vài ngày hoặc vài tuần, với ba di chứng chính: (1) tăng mức độ glucose tăng máu, (2) tăng sử dụng các chất béo cho năng lượng và cho sự hình thành cholesterol ở gan, và (3) sự suy giảm của protein của cơ thể. Khoảng 5-10% những người bị đái tháo đường type 1.
Nồng độ glucose trong máu tăng cao trong bệnh đái tháo đường.
Việc thiếu insulin làm giảm hiệu quả của việc sử dụng glucose ở ngoại vi và tăng cường sản xuất glucose, nâng đường huyết lên đến 300-1200mg /100 ml. Đường huyết tăng sau đó có nhiều hiệu ứng trên khắp cơ thể.
Tăng gluose trong máu gây mất glucose trong nước tiểu.
Nồng độ cao của đường trong máu gây ra nhiều glucose được lọc vào ống thận hơn lượng có thể được tái hấp thu, làm cho glucose xuất hiện trong nước tiểu. Điều này thường xảy ra khi nồng độ glucose máu tăng trên 180mg/100ml, một mức độ mà được gọi là “ngưỡng” cho sự xuất hiện của glucose trong nước tiểu. Khi mức độ đường trong máu tăng lên đến 300-500 mg/100 ml là giá trị phổ biến ở những người mắc đái tháo đường nặng không được điều trị, có thể có hơn 100 gram glucose có thể bị mất qua nước tiểu mỗi ngày.
Tăng glucose trong máu gây mất nước.
Nồng độ rất cao của đường trong máu (đôi khi cao tới 8-10 lần bình thường trong bệnh tiểu đường nặng không được điều trị) có thể gây mất nước tế bào nghiêm trọng khắp cơ thể. mất nước này xảy ra một phần vì glucose không khuếch tán dễ dàng thông qua màng tế bào, và tăng áp lực thẩm thấu trong dịch ngoại bào gây ra chuyển nước ra khỏi tế bào. Ngoài tác dụng mất nước trực tiếp của lượng đường quá mức, sự mất mát của glucose trong nước tiểu gây đa niệu thẩm thấu, nghĩa là, hiệu quả thẩm thấu của glucose ở ống thận rất nhiều làm giảm tái hấp thu nước ở ống thận. Hiệu quả tổng thể là mất mát lớn của nước trong nước tiểu, gây ra tình trạng mất nước của dịch ngoại bào, nó sẽ gây ra tình trạng mất nước của bên trong tế bào. Như vậy, gây đa niệu (polyuria), mất nước nội bào và ngoại bào. Khát nước nhiều là triệu chứng điển hình của bệnh tiểu đường.
Nồng độ glucose cao kéo dài gây tổn thương mô.
Khi nồng độ glucose không được kiểm soát kéo dài trong đái tháo đường, mạch máu trong nhiều mô khắp cơ thể bắt đầu hoạt động bất thường và trải qua những thay đổi về cấu trúc dẫn đến thiếu máu cung cấp cho các mô. tình hình này lần lượt dẫn đến tăng nguy cơ tổn thương tim, đột quỵ, ở bệnh thận giai đoạn cuối: bệnh võng mạc và mù lòa, và thiếu máu và hoại tử các chi.
Nồng độ glucose cao mạn tính cũng gây tổn thương cho nhiều mô khác. Ví dụ, bệnh thần kinh ngoại vi, đó là chức năng bất thường của các dây thần kinh ngoại biên, và rối loạn chức năng hệ thống thần kinh tự chủ là những biến chứng thường gặp ở đái tháo đường kéo dài và đái tháo đường không được kiểm soát. Những bất thường có thể dẫn đến phản xạ tim mạch bị suy yếu, kiểm soát bàng quang bị suy yếu, giảm cảm giác ở các chi, và các triệu chứng khác của tổn thương thần kinh ngoại vi.
Cơ chế chính xác gây tổn thương mô trong bệnh tiểu đường chưa được hiểu rõ nhưng có lẽ liên quan đến nhiều ảnh hưởng của nồng độ glucose cao và rối loạn chuyển hóa khác trên protein của tế bào nội mô và các tế bào cơ trơn mạch máu, cũng như các mô khác. Ngoài ra, tăng huyết áp, tổn thương thận thứ phát và xơ vữa động mạch, bất thường chuyển hóa lipid thứ phát, thường phát triển ở những bệnh nhân bị bệnh tiểu đường và khuếch đại các tổn thương mô do nồng độ glucose tăng cao.
Đái tháo đường gây tăng sử dụng chất béo và nhiễm toan chuyển hóa.
Sự thay đổi chuyển hóa carbohydrate, chất béo trong bệnh tiểu đường làm tăng giải phóng các keto acid, chẳng hạn như acid acetoacetic và acid β-hydroxybutyric, vào huyết tương nhanh hơn chúng có thể bị bắt giữ và bị oxy hóa bởi các tế bào mô. Kết quả là, toan chuyển hóa phát triển từ các keto acid dư thừa, trong đó, kết hợp với mất nước do sự hình thành nước tiểu quá mức, có thể gây nhiễm toan nặng. Kịch bản này dẫn nhanh tới hôn mê do tiểu đường và chết trừ khi bệnh nhân được điều trị ngay lập tức với một lượng lớn insulin.
Tất cả quá trình bù đắp sinh lý xảy ra trong nhiễm toan chuyển hóa trong tiểu đường. Bao gồm thở nhanh và sâu, gây tăng thải carbon dioxide; cơ chế này giúp giảm nhiễm toan nhưng làm suy giảm dự trữ kiềm trong dịch ngoại bào. Thận bù đắp bằng cách giảm bicarbonate bài tiết và tạo ra bicarbonate mới được thêm vào sao để dịch ngoại bào.
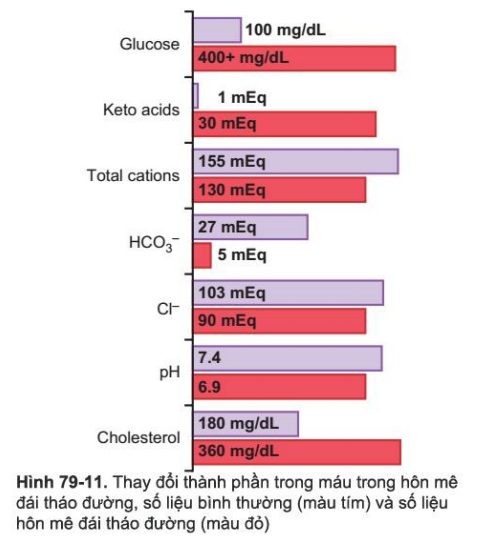
Mặc dù nhiễm acid nặng chỉ xảy ra trong các trường hợp nghiêm trọng nhất của bệnh tiểu đường không được kiểm soát, khi độ pH của máu giảm xuống dưới 7,0, hôn mê do nhiễm toan và tử vong có thể xảy ra trong vòng vài giờ. Những thay đổi tổng thể các chất điện giải trong máu là kết quả của nhiễm toan tiểu đường nghiêm trọng được hiển thị trong Hình 79-11.
Sử dụng chất béo dư thừa trong gan xảy ra trong một thời gian dài gây ra xuất hiện một lượng lớn cholesterol trong máu và tăng lắng đọng cholesterol trong thành động mạch. Tình trạng này dẫn đến xơ cứng động mạch nặng và tổn thương mạch máu khác, như đã bàn luận trước đó.
Bệnh tiểu đường: Nguyên nhân suy giảm của protein của cơ thể.
Giảm sử dụng glucose để sinh năng lượng dẫn đến tăng sử dụng và giảm lượng lưu trữ của các protein và chất béo. Vì vậy, một người bị đái tháo đường nghiêm trọng không được điều trị sút cân nhanh chóng và suy nhược (thiếu năng lượng) mặc dù ăn nhiều thực phẩm (polyphagia). Nếu không điều trị, các rối loạn chuyển hóa có thể gây hao hụt nghiêm trọng của các mô cơ thể và tử vong trong vòng một vài tuần.
ĐÁI THÁO ĐƯỜNG TYPE 2 – KHÁNG INSULIN
Bệnh tiểu đường type 2 là phổ biến hơn so với type 1, chiếm khoảng 90% đến 95% của tất cả các bệnh nhân đái tháo đường. Trong hầu hết các trường hợp, sự khởi đầu của bệnh tiểu đường type 2 xảy ra sau tuổi 30, thường ở độ tuổi từ 50 đến 60, và bệnh phát triển dần dần. Do đó, hội chứng này thường được gọi là bệnh tiểu đường khởi phát ở người trưởng thành. Trong những năm gần đây, tuy nhiên, đã có sự gia tăng ổn định về số lượng các bệnh nhân trẻ, một số trẻ hơn 20 tuổi, bị bệnh tiểu đường type 2. Xu hướng này xuất hiện có liên quan chủ yếu đến sự phổ biến ngày càng tăng của bệnh béo phì, yếu tố nguy cơ quan trọng nhất đối với bệnh tiểu đường type 2 ở trẻ em và người lớn.
Béo phì, kháng insulin, và “hội chứng chuyển hóa” thường đứng trước sự phát triển của bệnh tiểu đường type 2.
Ngược lại với bệnh tiểu đường type 1, bệnh tiểu đường type 2 có sự tăng nồng độ insulin huyết tương. Tăng insulin xảy ra như là một phản ứng bù bởi các tế bào beta đảo tụy kháng insulin, sự nhạy cảm của mô đích với tác dụng chuyển hóa của insulin bị suy giảm. Sự giảm sút trong làm suy yếu sự nhạy cảm insulin sử dụng carbohydrate và lưu trữ, tăng glucose máu và kích thích tăng bù tiết insulin.
Sự phát triển của kháng insulin và chuyển hóa glucose thường là một quá trình dần dần, bắt đầu với việc tăng cân quá mức và béo phì. Các cơ chế liên kết béo phì với kháng insulin vẫn chưa chắc chắn, tuy nhiên. Một số nghiên cứu cho rằng đối tượng béo phì có các thụ thể insulin ít hơn, đặc biệt là trong các cơ bắp, gan và mô mỡ xương, hơn làm đối tượng nạc. Tuy nhiên, hầu hết hầu hết kháng insulin xuất hiện được gây ra bởi sự bất thường của đường tín hiệu liên kết receptor với nhiều hiệu ứng của tế bào. Suy giảm tín hiệu insulin có thể liên quan chặt chẽ với các hiệu ứng độc hại do tích tụ lipid trong các mô như cơ xương và gan như một kết quả của việc tăng cân quá mức.
Kháng insulin là một phần của một loạt các rối loạn chức năng mà thường được gọi là “ hội chứng chuyển hóa” bao gồm: (1) béo phì, đặc biệt là tích tụ mỡ bụng; (2) kháng insulin; (3) tăng đường huyết lúc đói; (4) bất thường lipid máu, chẳng hạn như tăng triglyceride máu và giảm highdensity lipoprotein-cholesterol (HDL); và (5) tăng huyết áp. Tất cả các đặc điểm của hội chứng chuyển hóa có liên quan chặt chẽ đến sự tích tụ của các mô mỡ dư thừa trong khoang bụng xung quanh các cơ quan nội tạng.
Vai trò của kháng insulin trong việc đóng góp vào một số các thành phần của hội chứng chuyển hóa là không chắc chắn, mặc dù rõ ràng là đề kháng insulin là nguyên nhân chính của việc tăng nồng độ glucose trong máu. Một hệ quả bất lợi chính của hội chứng chuyển hóa là bệnh tim mạch, bao gồm cả xơ vữa động mạch và tổn thương đến các cơ quan khác nhau trong cơ thể. Một số rối loạn chuyển hóa có liên quan đến tăng nguy cơ bệnh tim mạch và kháng insulin dẫn đến sự phát triển của bệnh đái tháo đường type 2, đó cũng là một nguyên nhân chính của bệnh tim mạch.
Các yếu tố khác gây ra kháng insulin và tiểu đường type 2

Mặc dù hầu hết các bệnh nhân tiểu đường type 2 thừa cân hoặc có sự tích lũy đáng kể lượng mỡ nội tạng, kháng insulin nghiêm trọng và tiểu đường type 2 cũng có thể xảy ra như là kết quả của những nguyên nhân mắc phải hoặc di truyền khác làm suy yếu tín hiệu insulin ở các mô ngoại vi (Bảng 79-2).
Hội chứng buồng trứng đa nang (PCOS), ví dụ, có liên quan với sự gia tăng rõ ràng trong sản xuất androgen buồng trứng và đề kháng insulin. PCOS là một trong những rối loạn nội tiết phổ biến nhất ở phụ nữ, ảnh hưởng đến khoảng 6% tất cả phụ nữ trong suốt cuộc đời sinh sản của mình. Mặc dù cơ chế bệnh sinh của PCOS vẫn không chắc chắn, kháng insulin và tăng insulin được tìm thấy trong khoảng 80% phụ nữ bị ảnh hưởng. Những hậu quả lâu dài bao gồm tăng nguy cơ đái tháo đường, tăng lipid máu, và bệnh tim mạch.
Dư thừa glucocorticoid (hội chứng Cushing) hoặc dư thừa hormone tăng trưởng (Bệnh to cực chi) cũng làm giảm sự nhạy cảm của các mô khác nhau với các hiệu ứng chuyển hóa của insulin và có thể dẫn đến sự phát triển của bệnh tiểu đường. Nguyên nhân di truyền của bệnh béo phì và kháng insulin, nếu đủ nặng, cũng có thể dẫn đến bệnh tiểu đường type 2 và nhiều đặc trưng khác của hội chứng chuyển hóa, bao gồm cả bệnh tim mạch.
Sự phát triển của bệnh tiểu đường type 2 trong kháng insulin kéo dài.
Với kháng insulin kéo dài và nghiêm trọng, thậm chí mức tăng insulin không đủ để duy trì điều hòa glucose bình thường. Kết quả là, tăng đường huyết vừa phải xảy ra sau khi tiêu thụ carbohydrate trong các giai đoạn sớm của bệnh. Trong giai đoạn sau của bệnh tiểu đường type 2, các tế bào beta đảo tụy trở nên “kiệt sức” hoặc bị tổn thương và không thể sản xuất đủ insulin để tránh tăng đường huyết nghiêm trọng hơn, đặc biệt là sau khi người ăn một bữa ăn giàu cacbohydrate.
Trên lâm sàng bệnh đái tháo đường có ý nghĩa không bao giờ phát triển ở một số người béo phì, mặc dù họ đã có kháng insulin rõ ràng và tăng glucose trong máu sau bữa ăn lớn hơn bình thường; rõ ràng, tuyến tụy ở những người sản xuất insulin đủ để ngăn chặn bất thường nghiêm trọng của quá trình chuyển hóa glucose. Tuy nhiên, ở những người béo phì khác, tuyến tụy dần dần trở nên kiệt sức do phải tiết ra một lượng lớn insulin hoặc bị hư hại bởi các yếu tố liên quan đến sự tích tụ chất béo trong tuyến tụy, bệnh tiểu đường phát triển mạnh xảy ra. Một số nghiên cứu cho rằng yếu tố di truyền đóng một vai trò quan trọng trong việc xác định tuyến tụy của một cá nhân có thể duy trì sản lượng insulin cao trong nhiều năm qua đó là cần thiết để tránh những bất thường nghiêm trọng của quá trình chuyển hóa glucose trong bệnh tiểu đường type 2. Trong nhiều trường hợp, bệnh tiểu đường type 2 có thể được điều trị hiệu quả, ít nhất là trong giai đoạn đầu, kết hợp với tập thể dục, hạn chế calo và giảm cân, và không cần sử dụng insulin ngoại sinh. Những loại thuốc làm tăng độ nhạy cảm với insulin như thiazolidinediones, thuốc ức chế sản xuất glucose gan, như metformin, hoặc thuốc gây thêm giải phóng insulin của tuyến tụy, như sulfonylurea, cũng có thể được sử dụng. Tuy nhiên, trong giai đoạn sau của bệnh tiểu đường type 2, tiêm insulin thường được yêu cầu để kiểm soát mức độ đường huyết. Thuốc có thể bắt chước các tác động của incretin GLP-1 đã được phát triển để điều trị bệnh tiểu đường type 2. Những loại thuốc tăng cường sự bài tiết insulin và đang dự định sẽ được sử dụng kết hợp với các thuốc trị đái tháo đường khác. Một phương pháp điều trị là ức chế enzyme dipeptidyl peptidase 4 (DPP-4), làm bất hoạt GLP-1 và GIP. Bằng cách ngăn chặn hoạt động của DPP-4, ảnh hưởng của GLP-1 và GIP có thể được kéo dài, dẫn đến tăng tiết insulin và cải thiện kiểm soát đường huyết.
SINH LÝ CHẨN ĐOÁN ĐÁI THÁO ĐƯỜNG
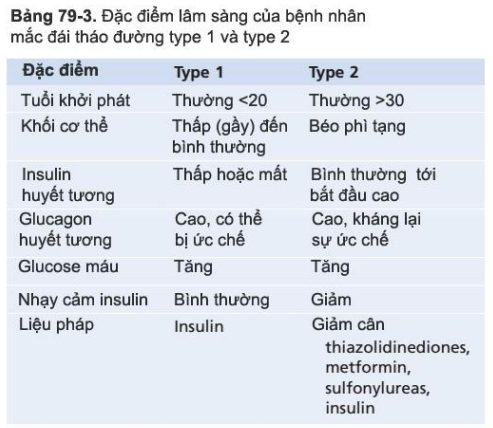
Bảng 79-3 so sánh một vài đặc điểm lâm sàng của đái tháo đường type 1 và type 2. Phương pháp thường dùng để chẩn đoán đái tháo đường dựa trên thay đổi trên xét nghiệm máu và xét nghiệm nước tiểu.
Glucose niệu.
Các xét nghiệm chính quy thông thường hoặc các xét nghiệm định lượng phức tạp hơn có thể được sử dụng để xác định lượng glucose bị mất trong nước tiểu. Nói chung, một người bình thường không thể phát hiện glucose trong nước tiểu, trong khi một người bị bệnh tiểu đường sẽ phát hiện một lượng glucose nhỏ hay lớn trong nước tiểu, tương ứng với mức độ nghiêm trọng của bệnh và lượng carbohydrate dung nạp.
Mức độ insulin và glucose lúc đói.
Đường huyết lúc đói vào buổi sáng sớm thường là 80-90mg/100ml, và 110mg/100ml được coi là giới hạn trên người bình thường. Mức đường huyết lúc đói cao hơn giá trị này thường chỉ ra bệnh đái tháo đường hoặc ít nhất đánh dấu sự kháng insulin. Ở những người có bệnh tiểu đường type 1, nồng độ insulin trong huyết tương rất thấp hoặc không phát hiện được khi đói và thậm chí sau một bữa ăn. Ở những người có bệnh tiểu đường type 2, nồng độ insulin huyết tương có thể cao hơn bình thường vài lần và thường tăng đến một mức độ lớn hơn sau khi uống một lượng glucose tiêu chuẩn trong một thử nghiệm dung nạp glucose (xem phần tiếp theo).
Nghiệm pháp dung nạp glucose.
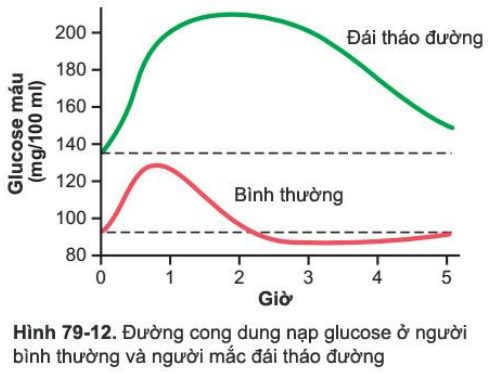
Như minh chứng bởi các đường cong phía dưới trong hình 79-12, được gọi là “đường cong dung nạp glucose,” khi một người bình thường đang ở trạng thái đói, người đó dung nạp 1 gram glucose cho mỗi kg trọng lượng cơ thể, mức độ glucose máu tăng từ khoảng 90 mg/100 ml đến 120-140 mg /100ml và rơi trở lại dưới mức bình thường trong khoảng 2 giờ.
Một người mắc đái tháo đường, nồng độ glucose lúc đói hầy như luôn cao hơn 110mg/100ml và thường cao hơn 140mg/100ml. Thêm vào đó, kết quả của nghiệm pháp dung nạp glucose hầu như luôn luôn bất thường. Sau khi uống glucose, những người được cho uống thuốc có sự gia tăng lớn hơn nhiều do với bình thường ở mức độ glucose trong máu, như chứng minh bằng các đường cong trên trong hình 79-12, và mức độ glucose rơi trở lại với giá trị kiểm soát chỉ sau 4-6 giờ; Hơn nữa, nó không thấp hơn mức độ glucose chứng. Sự giảm chậm của đường cong này và sự thất bại của nó trong việc giảm xuống dưới mức chứng chứng minh rằng hoặc (1) sự tăng tiết insulin bình thường sau dung nạp glucose không xảy ra hoặc (2) người đó bị giảm nhạy cảm với insulin. Một chẩn đoán đái tháo đường thường có thể được thành lập trên cơ sở một đường cong như vậy, và bệnh tiểu đường type 1 và type 2 có thể được phân biệt với nhau bằng định lượng insulin huyết tương, với nồng độ insulin huyết tương thấp hoặc không thể phát hiện thì có chẩn đoán bệnh tiểu đường type 1 và tăng ở bệnh tiểu đường loại 2.
Hơi thở Aceton.
Như đã chỉ ra trong Chương 69, một lượng nhỏ axit acetoacetic trong máu, làm chất tăng đáng kể trong bệnh tiểu đường nặng, được chuyển thành acetone. Acetone dễ bay hơi và được bay hơi vào không khí thở ra. Do đó, một trong những tiêu chuẩn thường xuyên có thể dùng để chẩn đoán đái tháo đường type 1 chỉ bằng cách ngửi acetone trong hơi thở của bệnh nhân. Ngoài ra, các axit keto trong nước tiểu có thể được phát hiện bằng các phương tiện, hóa chất, và hỗ trợ định lượng chúng trong việc xác định mức độ nghiêm trọng của bệnh tiểu đường. Trong giai đoạn đầu của bệnh tiểu đường type 2, tuy nhiên, các axit keto thường không được sản xuất với số lượng dư thừa. Tuy nhiên, khi kháng insulin trở nên trầm trọng và việc sử dụng các chất béo cho năng lượng tăng lên rất nhiều, axit keto sau đó được sản xuất ở những người bị bệnh tiểu đường type 2.
ĐIỀU TRỊ ĐÁI THÁO ĐƯỜNG
Hiệu quả điều trị của tiểu đường type 1 yêu cầu cung cấp đủ insulin để các bệnh nhân có chuyển hóa carbohydrate, chất béo, và protein càng bình thường càng tốt. Insulin có một số dạng. Insulin “Thường xuyên” có thời gian tác dụng kéo dài 3-8 giờ, trong khi các hình thức khác của insulin (kết tủa với kẽm hoặc với các dẫn xuất protein khác nhau) được hấp thụ chậm từ chỗ tiêm và do đó có tác dụng kéo dài đến 10 đến 48 giờ. Thông thường, một bệnh nhân bị bệnh tiểu đường type 1 nặng được cho một liều duy nhất một trong những loại insulin tác dụng dài mỗi ngày để làm tăng chuyển hóa carbohydrate tổng thể trong suốt cả ngày. Số lượng bổ sung insulin thường xuyên sau đó được đưa ra trong ngày ở những lần khi mức đường huyết có xu hướng tăng quá cao, chẳng hạn như vào giờ ăn. Như vậy, mỗi bệnh nhân được cung cấp với một mô hình điều trị cá nhân.
Trong quá khứ, insulin được sử dụng để điều trị được bắt nguồn từ tuyến tụy động vật. Tuy nhiên, insulin người sản xuất bởi quá trình tái tổ hợp DNA đã trở thành sử dụng rộng rãi hơn vì khả năng miễn dịch và sự nhạy cảm với insulin động vật tiến triển ở một số bệnh nhân, do đó hạn chế hiệu quả của nó.
Ở những người có bệnh tiểu đường type 2, ăn kiêng và tập thể dục thường được khuyến cáo trong một nỗ lực để tạo ra sự mất cân và đảo ngược sự đề kháng insulin. Nếu chiến lược này không thành công, thuốc có thể được dùng để tăng độ nhạy cảm insulin hoặc để kích thích tăng sản xuất insulin của tuyến tụy, như đã thảo luận trước đó. Tuy nhiên Ở nhiều người, insulin ngoại sinh phải được sử dụng để điều chỉnh nồng độ đường trong máu.
U ĐẢO TỤY – TĂNG INSULIN
Mặc dù sản xuất insulin quá mức xảy ra hiếm hơn nhiều bệnh tiểu đường, nó đôi khi có thể là hậu quả của một u tuyến (adenoma) của một tiểu đảo Langerhans. Khoảng 10 đến 15 phần trăm của các u tuyến là ác tính, và đôi khi di căn từ các tiểu đảo Langerhans lây lan khắp cơ thể, gây ra sản xuất một lượng lớn insulin bởi cả ung thư nguyên phát và di căn. Thật vậy, một số bệnh nhân đã cần hơn 1000 gram glucose mỗi 24 giờ để ngăn ngừa hạ đường huyết.
Shock insulin và hạ đường huyết
Như đã nhấn mạnh, hệ thống thần kinh trung ương thường về cơ bản tất cả nguồn năng lượng xuất phát từ quá trình chuyển hóa glucose và insulin là không cần thiết để sử dụng glucose. Tuy nhiên, nếu nồng độ cao của insulin gây ra lượng đường trong máu giảm xuống mức thấp, sự trao đổi chất của hệ thống thần kinh trung ương trở nên kém. Do đó, ở những bệnh nhân có khối u tiết insulin hoặc ở những bệnh nhân bị bệnh tiểu đường, bệnh nhân dùng quá nhiều insulin cho chính họ, các hội chứng đó được gọi là sốc insulin có thể xảy ra như sau.
Khi nồng độ glucose máu rơi vào khoảng từ 50 đến 70 mg/100 ml, hệ thống thần kinh trung ương thường trở nên dễ bị kích động vì hoạt động thần kinh nhạy cảm với mức độ hạ đường huyết. Đôi khi gây ra các hình thức khác nhau của ảo giác, nhưng thường xuyên hơn ở các bệnh nhân chỉ đơn giản là trải qua căng thẳng cực độ, run rẩy toàn thân, và vã mồ hôi. Khi mức đường trong máu giảm xuống 20-50 mg/100 ml, bệnh nhân có thể lên cơn co giật và mất ý thức. Khi mức glucose rơi vẫn còn thấp hơn, các cơn co giật chấm dứt và chỉ có một trạng thái hôn mê. Thật vậy, khi sử dụng quan sát lâm sàng đơn giản, đôi khi rất khó để phân biệt giữa hôn mê đái tháo đường là một kết quả của nhiễm toan do thiếu insulin và hôn mê do hạ đường huyết do insulin dư thừa. Hơi thở acetone và, hít thở sâu nhanh của người trong tình trạng hôn mê đái tháo đường là không có ở những người trong tình trạng hôn mê hạ đường huyết. Điều trị thích hợp cho một bệnh nhân có sốc hạ đường huyết hoặc hôn mê là tiêm tĩnh mạch trực tiếp của số lượng lớn glucose. điều trị này thường mang đến cho các bệnh nhân ra khỏi sốc trong một phút hoặc hơn. Ngoài ra, Sử dụng glucagon (hoặc, ít hiệu quả hơn, epinephrine) có thể gây ra thoái hóa glycogen trong gan và do đó làm tăng lượng đường trong máu vô cùng nhanh chóng. Nếu không chữa trị ngay lập tức, thường xảy ra tổn thương vĩnh viễn cho các tế bào thần kinh của hệ thần kinh trung ương.
Bài viết được dịch từ sách: Guyton and Hall text book of Medical and Physiology
 Y khoa Ykhoa, y học, y tế, kiến thức, lâm sàng, cận lâm sàng, chẩn đoán, điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.
Y khoa Ykhoa, y học, y tế, kiến thức, lâm sàng, cận lâm sàng, chẩn đoán, điều trị, phác đồ, diễn đàn y khoa, hệ sinh thái y khoa online, mới nhất và đáng tin cậy.